okteta teorija ierosināja Ņūtons Lūiss, kurš pētījumos novēroja, ka notiek atomu mijiedarbība lai katrs elements iegūtu cēlgāzes elektronisko stabilitāti, tas ir, astoņi elektroni valences slānis. Tomēr dažās molekulās notiek tā sauktais okteta paplašināšanās vai saraušanās, tas ir, centrālais atoms izveido vairāk vai mazāk paredzētas saites.
Lasiet arī: Kovalentās saites - klasifikācijas un raksturojums
Kā darbojas oktetu teorija?
Protams, visas sistēmas mēdz meklēt veidu, kā iegūt pēc iespējas lielāku stabilitāti, un tas neatšķiras ar atomu. Atomi ir jebkura materiāla “bāzes daļiņas”, un katra no tiem ir elektrosfērā. Šī elektrosfēra tika sadalīta ar Linuss Polings enerģijas līmeņos un apakšlīmeņos. Paulings izstrādāja diagrammu, lai parādītu, kā varētu izskatīties elektronu sadalījums ap atoma kodolu.
Skatiet attēlu zemāk:
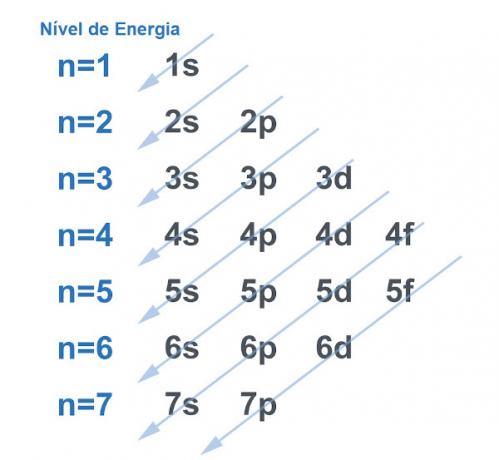
Katrs līmenis un apakšlīmenis satur summu elektroni. Veidojot līdzību, mēs varam teikt, ka katrs līmenis ir plaukts, un katrs apakšlīmenis ir lodziņš. Katrā kastē ievietojiet divus elektronus. Atoms ir stabils, ja visi tā elektroni ir sapāroti, tas ir, kad ir visas kastes ar diviem elektroniem katrā.
Piemērs:
Veiksim elektronisko skābekļa (O) sadali, kura dabiskajā stāvoklī ir astoņi elektroni.
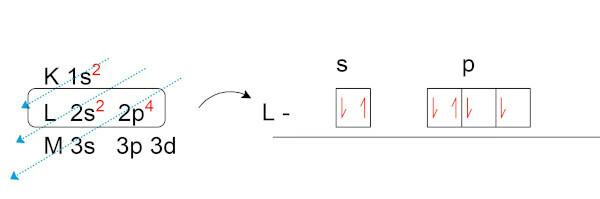
Ievērojiet, ka valences slānī (L slānī, p apakšlīmenī) mums ir divi nepāra elektroni. Tieši šie elektroni izveido ķīmiskās saites ar citiem elementiem vēlas veidot elektroniskus pārus.
Oktetu teorijas pamatā ir elektronu summēšanas matemātika. Ja visās pēdējās elektronu čaulas apakšlīmeņās ir pa diviem elektroniem, valences apvalkā kopā būs astoņi elektroni un līdz ar to atoms būs stabils.
Lasiet arī: Kvantu skaitļi - skaitļi, kas saistīti ar elektrona enerģijas daudzumu
Nepārtrauciet tūlīt... Pēc reklāmas ir vairāk;)
cēlās gāzes
Cēlās gāzes ir vienīgie elementi, kas dabā var atrast monoatomiskā formā, tas ir, nenodibinot saiti ar citu atomu. Tas ir tāpēc, ka tiem ir elektroniska stabilitāte. Gandrīz visiem no tiem valences apvalkā ir astoņi elektroni., ievērojot okteta likumu, izņemot hēlija gāzi, kurai ir tikai divi elektroni.

Izņēmumi oktetu teorijā
Dažiem savienojumiem izdodas stabilizēties ar vairāk vai mazāk par astoņiem elektroniem valences apvalkā. Šajos gadījumos notiek okteta teorijas izņēmumi.
okteta izplešanās
Tas notiek galvenokārt ar fosforu (P) un sēru (S), kas ir salīdzinoši lieli atomi un kuriem ir “d” apakšlīmenis. Šajā gadījumā atoms pēdējā apvalkā satur vairāk nekā astoņus elektronus.
Piemērs:
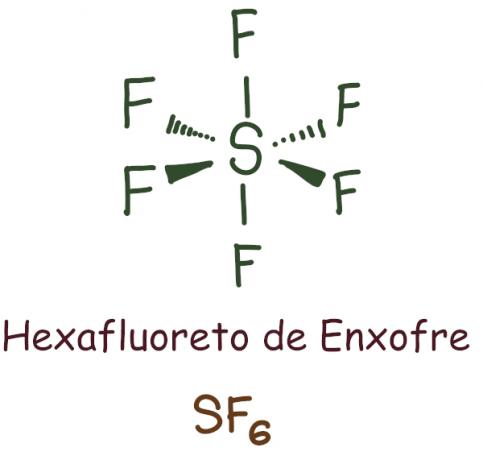
Sēra heksafluorīda gadījumā centrālais elements tika atstāts 12 elektroni, pārsniedzot 8, kas nepieciešami, lai stabilizētos saskaņā ar okteta likumu. Šajā gadījumā notika okteta paplašināšanās.
okteta kontrakcija
Notiek ar beriliju (Be), boru (B) un dažiem oksīdi slāpekļa. Skatiet piemēru:
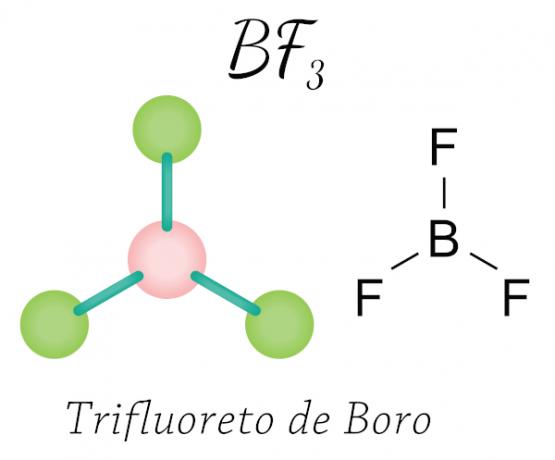
Bora trifluorīda gadījumā fluora atomi iegūst nepieciešamos astoņus elektronus valences apvalkā, daloties elektroniski ar boru, ievērojot okteta likumu, bet centrālais atoms (bors) nestabilizējas ar sešiem elektroniem, tādējādi viens okteta saraušanās.
Piekļūstiet arī: Sigma saites klasifikācija: kādi ir kritēriji?
atrisināti vingrinājumi
jautājums 1 - (Mackenzie-SP) Lai sēra un kālija atomi iegūtu elektronisku konfigurāciju, kas ir vienāda ar cēlgāzi, ir nepieciešams:
(Dati: atomu skaitlis S = 16; K = 19.)
A) sērs saņem 2 elektronus, bet kālijs - 7 elektronus.
B) sērs dod 6 elektronus un kālijs saņem 7 elektronus.
C) sērs dod 2 elektronus, bet kālijs - 1 elektronu.
D) sērs saņem 6 elektronus, un kālijs atsakās no 1 elektrona.
E) sērs saņem 2 elektronus, un kālijs atsakās no 1 elektrona.
Izšķirtspēja
E alternatīva Sērs ir 16. ailes vai 6.A saimes elements. Šīs ģimenes elementi mēdz uztvert divus elektronus, veidojot elektroniskus pārus, un valences apvalkā kopumā ir astoņi elektroni. 1A ģimenes elementiem, kas ir sārmu metāli, valences apvalkā ir tikai viens elektrons. Ziedojot šo elektronu, iepriekšējais slānis kļūst par valences slāni, jau ar astoņiem elektroniem, kā to nosaka okteta likums.
2. jautājums - Spriediet šādus apgalvojumus kā patiesus (T) vai nepatiesus (F).
I () Okteta noteikums nosaka, ka valences apvalkā nepieciešami astoņi elektroni, lai atoms būtu stabils.
II () Valences slānis ir otrais atoma elektroniskais slānis.
III () Hlors (Cl) no halogēnu grupas mēdz iegūt divus elektronus, lai iegūtu stabilitāti.
IV () Nātrijs (Na), 1A ģimenes elements, mēdz zaudēt vienīgo elektronu savā valences apvalkā.
Atzīmējiet pareizo alternatīvu:
A) I, III un IV ir taisnība.
B) I un IV ir taisnība.
C) Tikai II ir taisnība.
D) Tikai IV ir nepatiesa.
E) Visi ir patiesi.
Izšķirtspēja
B alternatīva Es un IV ir taisnība. II apgalvojums ir nepareizs, jo valences slānis ir pēdējais atoma elektroniskais slānis, nevis otrais. Un paziņojumā III teikts, ka hlors mēdz iegūt divus elektronus, kas nepārbauda, jo hlors ir no 7.A vai 17. ģimene, parasti iegūst tikai vienu elektronu, lai tādējādi iegūtu gāzes elektronisko konfigurāciju cēls.
Autors Laysa Bernardes Marques de Araújo
Ķīmijas skolotājs