Pirms runāt par nomenklatūru a kvartāra amonija sāls pareizi, ir svarīgi atcerēties, kas ir šis organiskais savienojums. Kvaternārais amonija sāls rodas, aizvietojot ūdeņražus, kas atrodas amonija katjonā (NH4+) par radikāļi bioloģiski, kā parādīts zemāk:
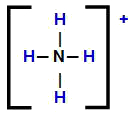
Amonija katjona strukturālā formula
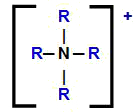
Amonija katjona strukturālā formula ar tās ūdeņražiem, kas aizstāti ar organiskiem radikāļiem
Papildus ūdeņražu aizstāšanai katram kvaternārajam amonija sālim ir kāds anjons, kas pavada amonija atvasināto katjonu. Tādējādi mēs varam attēlot šī savienojuma vispārējo strukturālo formulu šādi:
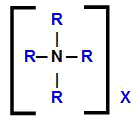
Kvaternārā amonija sāls vispārīgā strukturālā formula
Tādējādi ir acīmredzams, ka kvaternārā amonija sāls formulā mums ir četri organiski radikāļi, vienādi vai dažādi, un jebkurš anjons (X). Lai veiktu šo savienojumu nomenklatūru, mums ir jāņem vērā šis fakts.
Skatiet, kā kvaternārā amonija sāls nomenklatūra saskaņā ar IUPAC (Starptautiskā tīrās un lietišķās ķīmijas savienība):
Anjona nosaukums + de + radikāļu nosaukums alfabētiskā secībā + amonijs
Tagad sekojiet dažiem piemēri noteikumu piemērošana kvaternāro amonija sāļu nomenklatūra:
Benziloktadecil-dimetilamonija jodīds
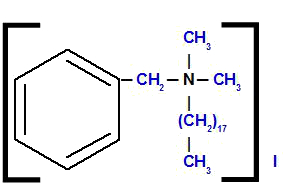
Analizējot struktūru, mēs novērojam, ka anjons savienojumā ir Es, ko sauc jodīds. Pa kreisi no struktūras mums ir radikāls benzilgrupa (benzola savienojums ar CH grupu2). Augšā un labajā pusē mums ir divi radikāļi metilgrupa (CH3), ko sauks par “dimetilgrupu”. Apakšā mums ir radikāls oktadecilgrupa, kura ķēdē ir astoņpadsmit oglekļa atomu.
Nepārtrauciet tūlīt... Pēc reklāmas ir vairāk;)
Tādējādi nosaukums sākas ar jodīdu, kam seko priekšvārds un nosaukums benzils, kam seko oktadecils (alfabētiskās kārtības dēļ) un, visbeidzot, dimetils ar amoniju.
Novērošana: Termini okt un di nepiedalās salikto nosaukumu alfabētiskā secīgā organizācijā.
tetraetilamonija hlorīds
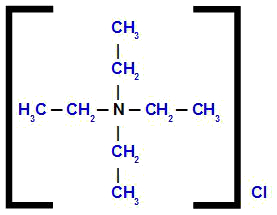
Analizējot struktūru, mēs novērojam, ka anjons savienojumā ir Cl, ko sauc hlorīds. Četri struktūrā esošie organiskie radikāļi ir etils (CH3-CH2-); tāpēc viņi saņem nosaukumu tetraetils.
Tādējādi nosaukums sākas ar hlorīdu, kam seko priekšvārds, plus nosaukums tetraetils, kam seko termins amonijs.
Benzil-tridecil-dimetilamonija bromīds

Analizējot struktūru, mēs novērojam, ka anjons savienojumā ir br, ko sauc bromīds. Pa kreisi no struktūras mums ir radikāls benzilgrupa (benzola savienojums ar CH grupu2). Augšā un labajā pusē mums ir divi radikāļi metilgrupa (CH3), ko sauks par “dimetilgrupu”. Apakšā mums ir radikāls tridecils, jo tās ķēdē ir trīspadsmit oglekļa atomu.
Tādējādi nosaukums sākas ar jodīdu, kam seko priekšvārds un vārds benzils, kam seko tridecils (alfabētiskās kārtības dēļ) un, visbeidzot, dimetils ar amoniju.
Difenil-dimetilamonija sulfāts
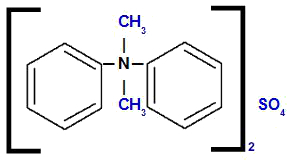
Analizējot struktūru, mēs novērojam, ka anjons savienojumā ir TIKAI4, ko sauc sulfāts. Struktūras kreisajā un labajā pusē mums ir fenilgrupa (benzols), ko sauks par “difenilu”. Augšā un apakšā mums ir metilradikāļi (CH3), ko sauks par “dimetilgrupu”.
Tādējādi nosaukums sākas ar sulfātu, kam seko priekšvārds, plus nosaukums difenils, kam seko dimetils (alfabētiskās kārtības dēļ) un, visbeidzot, amonijs.
Autors: Diogo Lopes Dias