Atomi ir bezgalīgi mazas daļiņas, kas veido visu Visuma matēriju. Laika gaitā ideja par to, kāda būtu atomu struktūra, mainījās saskaņā ar jauniem zinātnieku atklājumiem. Jūs varat uzzināt vairāk par to tekstāAtomu modeļa attīstība.
Modelis ir realitātes (nevis pašas realitātes) attēlojums, tāpēc atomu modeļi ir to attēlojums galvenās atoma sastāvdaļas un tā struktūra, un izskaidro noteiktu vielas fizikālo un ķīmisko uzvedību. Tas tiek darīts, jo cilvēkam vēl nav iespējams redzēt izolētu atomu pat ar ultramikroskopiem.
Lai iegūtu priekšstatu par to, cik mazs ir atoms, ziniet to The Vismazākā parastajā mikroskopā redzamā daļiņa satur vairāk nekā desmit miljardus atomu! Atoms ir tik mazs, ka, ja mēs saliktu miljonu no tiem blakus, mēs nesasniegtu matu biezums.
Prāta karte: Atom
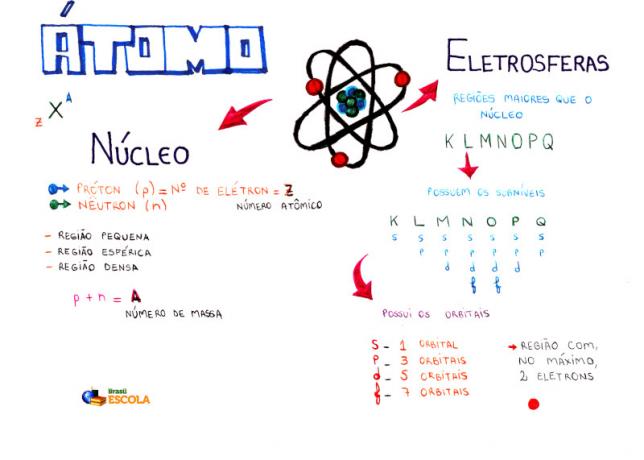
* Lai lejupielādētu domu karti PDF formātā, Noklikšķiniet šeit!
Starp atomu modeļiem šobrīd vidusskolā visbiežāk izmantotais atoma struktūras un tā īpašību izpratnei ir Rutherford-Bohr modelis. Saskaņā ar šo modeli atoma struktūra sastāv no divām galvenajām daļām: kodols un elektrosfēra.

Divas galvenās atoma struktūras daļas - elektrosfēra un kodols
* Kodols: Tā kā atoma centrālā daļa ir kompakta, masīva un ļoti blīva, turklāt to veido lielākas masas daļiņas, kas ir protoni un neitroni.

Protonu un neitronu ilustrācija, kas veido atomu kodolu
- protoni: tās ir daļiņas ar pozitīvu elektrisko lādiņu (relatīvais lādiņš = +1; lādiņš kulonā (C) = +1,602. 10-19) un tā relatīvā masa ir vienāda ar 1.
To, ka protoni veido kodolu un piešķir tam vispārēju pozitīvu lādiņu, atklāja Eižens Goldšteins, 1886. gadā, izmantojot modifikāciju Krūka ampulā un dažus eksperimentus. Viņš redzēja, ka zem ļoti augsta sprieguma parādījās emisijas (anoda stari - gāzes atomu paliekas, kas atradās spuldzes iekšpusē un kuru elektroni noplīsa elektriskā izlāde). Novietojot elektrisko vai magnētisko lauku ārpus spuldzes, šie stari tika novirzīti uz negatīvo polu. Tas nozīmēja, ka pastāv pozitīvas subatomiskās daļiņas, kuras sauca par protoniem.
Vēlāk Ernests Rezerfords (1871-1937) veica tekstā aprakstīto eksperimentu Rezerfordas atoms, kas lika viņam atklāt protona atrašanās vietu: kodolā.
- Neitroni: tās ir daļiņas, kuru masa ir vienāda ar protoniem (1), bet, kā norāda nosaukums, tās ir neitrālas, tas ir, tām nav elektriskā lādiņa.
Neitronus 1932. gadā atklāja Džeimss Čadviks (1891-1974), kurš saprata, ka radioaktīvā berilija kodols izstaro neitrālas daļiņas, kuru masa ir aptuveni vienāda ar protonu masu (patiesībā tā ir nedaudz lielāka).
Nepārtrauciet tūlīt... Pēc reklāmas ir vairāk;)
Kodola diametrs ir atkarīgs no atoma protonu un neitronu daudzuma, bet vidēji tas ir aptuveni 10-14 10. mēnesis-15 m.
Atoma kodols koncentrē praktiski visu atoma masu, kas ir ļoti maza daļa: gan protons, gan neitroni ir aptuveni 100 000 reižu mazāki par visu pašu atomu! Salīdzinājumam iedomājieties, ka mēs palielinām ūdeņraža elementa atoma kodolu (kuram ir tikai protonu) līdz tenisa bumbas izmēram, tuvākais elektrons būtu apmēram trīs kilometru attālumā attālums! Pat ja atoms tiktu palielināts līdz 14 stāvu ēkas augstumam, tā kodols būtu tikai sāls grauda lielums septītajā stāvā. Tas tiešām ir kaut kas pārsteidzošs, vai jūs nedomājat ?!
* Elektrosfēra: Ir reģions, kurā ap kodolu rotē elektroni. Neskatoties uz reģionu, kura tilpums ir daudz lielāks nekā kodols, tas praktiski ir tukšs, jo katrs elektrons ir 1836 reizes mazāks par 1 protonu (vai par 1 neitronu). Tāpēc atoma masa praktiski atrodas kodolā. Elektroni ir daļiņas ar negatīvu elektrisko lādiņu (-1).
Elektronus 1897. gadā atklāja Džozefs Džons Tomsons (1856-1940), autora Tomsona atomu modelis. Tomsona eksperimentu detalizēti var redzēt tekstā Tomsona eksperiments ar elektriskām izlādēm, bet īsi sakot, viņš izmantoja jau iepriekš minēto Krookes ampulu un saprata, ka katoda stari vienmēr bija piesaistīja pozitīvais pols, kas pierādīja, ka atomam bija negatīvas daļiņas, kuras sauca elektroni.
Elektroni griežas ap kodolu miljardiem sekundes sekundes miljondaļas, veidojot atomu un liekot uzvesties tā, it kā tas būtu ciets.
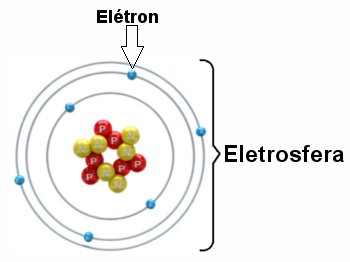
Elektrosfēras ilustrācija ar trim elektroniskiem slāņiem un elektroniem, kas rotē ap kodolu.
Īsāk sakot, mēs varam izveidot tabulu, lai atšķirtu trīs galvenās subatomiskās daļiņas, kas ir atoma struktūras daļa:

Trīs galveno subatomisko daļiņu - protonu, neitronu un elektronu - masa un elektriskais lādiņš
Visu ķīmisko elementu atomus veido šīs trīs subatomiskās daļiņas. Viens ķīmiskais elements atšķiras no daudzuma, kādā parādās šīs daļiņas, it īpaši protonu daudzums kodolā, ko sauc par atomu skaitli. Turpiniet to izpētīt, izmantojot tekstu. Ķīmiskais elements.
* Manu domu karte. Diogo Lopes
Autore Jennifer Fogaça
Beidzis ķīmiju
Ķīmija
Vielu, ūdens, ciānūdeņraža gāzes, oglekļa dioksīda, amonjaka, ūdeņraža, hēlija, vielu klasifikācija vienkāršas, saliktas vielas, maisījumi, maisījuma fāzes, viendabīgs maisījums, maisījums neviendabīgs.



