Pirms jēdziena molārā masa un molu skaits, apskatīsim dažas svarīgas definīcijas šajā kontekstā:
→ Molārs termins
Molārs nāk no vārda molekula, bet kas īsti ir molekula? Tas ir atomu kopums, kas ir saistīts ar ķīmiskām saitēm.
→ Molekulmasa (MM)
Molekulas masu ir iespējams aprēķināt pēc katra atoma, kas veido attiecīgo molekulu, atomu masu summas. Rezultātu sauc par molekulāro masu (MM).
Kāda būtu sērūdeņraža (H2S) piemēram?
Vispirms jums jāzina, kas atomu masa katra atoma, ko norāda periodiskā tabula elementi.
Ūdeņraža atoma masa (H) = 1 a.m.u. (vienība uz atomu masu)
Sēra atomu masa (S) = 32,1 au
Molekulmasa ir atomu atomu masu summa.
Piezīme: H molekulas ūdeņradis2S koeficients ir 2, tāpēc jums jāreizina tā masa ar 2. Aprēķina:
H molekulmasa2S = 1 • 2 + 32,1 = 34,1 u
(H) + (S) = (H)2S)
Molārā masa un molu skaits
Nepārtrauciet tūlīt... Pēc reklāmas ir vēl vairāk;)
Molārā masa, kā arī molu skaits ir saistīts ar Avogadro konstante (6,02 x 1023), izmantojot šādu jēdzienu:
1 elementā esošo elementu skaits atbilst Avogadro konstantei, kuras vērtība ir 6,02 x 1023 mol-1.''
Tāpēc molārā masa ir masa 6,02 x 1023 ķīmiskās vienības, un to izsaka g / mol.
Prāta karte - Mol
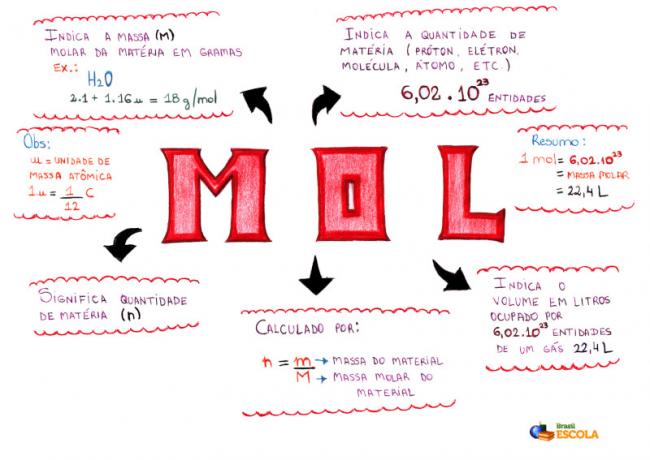
* Lai lejupielādētu domu karti, Noklikšķiniet šeit!
Piemērs: H2s
Molekulārā masa = 34,1 u
Molārā masa (M) = 34,1 g / mol
Tas nozīmē, ka pie 34,1 g / mol sērūdeņraža mums ir 6,02 x 1023 molekulas vai 1 mols sērūdeņraža molekulu.
Secinājums
Molekulmasai un molmasai ir vienādas vērtības, atšķirīgā ir mērvienība. Molārā masa ir saistīta ar molu skaitu, ko izsaka Avogadro konstante.
* Manu domu karte. Diogo Lopes
Autore Líria Alves
Beidzis ķīmiju
Vai vēlaties atsaukties uz šo tekstu skolas vai akadēmiskajā darbā? Skaties:
SOUZA, Líria Alves de. "Molārā masa un molu skaits"; Brazīlijas skola. Pieejams: https://brasilescola.uol.com.br/quimica/massa-molar-numero-mol.htm. Piekļuve 2021. gada 27. jūnijam.


