aktivācijas enerģija tas ir minimālais enerģijas daudzums, kas vajadzīgs, lai notiktu labvēlīgā orientācijā esoša reaģenta daļiņu sadursme un rezultātā notiktu reakcija.
Reakcijas notiek tikai tad, kad reaģentiem ir aktivācijas enerģija (vai minimālā nepieciešamā enerģija, kas mainās atkarībā no reakcijas; vai nu daudzumā, vai formā), vai arī tad, kad tas viņiem tiek piegādāts.
Piemēram, kad metāliskais nātrijs nonāk saskarē ar ūdeni, tas reaģē vardarbīgi. Tas nozīmē, ka šo reaģentu enerģijas saturs jau ir pietiekams, lai notiktu reakcija.
Plīts ieslēgšanas gadījumā sadegšanas reakcija notiks tikai tad, ja pie gāzes, ko plīts atbrīvo, mēs novietojam aizdedzinātu sērkociņu vai kādu citu uguns avotu. Tas nozīmē, ka šajā gadījumā bija nepieciešams piegādāt enerģiju sistēmai, lai tā sasniegtu aktivācijas enerģiju un notiktu reakcija.
Ja pats fosfors tiek izmantots tā sadedzināšanai, aktivācijas enerģiju nodrošina berze. Tas pats notiek ar šķiltavām, kurām nepieciešama arī dzirkstele, kas dod nepieciešamo aktivizācijas enerģiju tajās esošās gāzes sadedzināšanai.
Aktivizācijas enerģiju var nodrošināt arī gaisma, tāpat kā ūdeņraža peroksīda sadalīšanās gadījumā. Tāpēc tas tiek uzglabāts tumšās vai necaurspīdīgās pudelēs.
Nepārtrauciet tūlīt... Pēc reklāmas ir vairāk;)

Tādējādi mēs varam secināt, ka aktivācijas enerģija (Elīdz) ir starpība starp enerģiju, kas nepieciešama reakcijas sākšanai (E) un enerģiju, kas atrodas reaģentos (Epr):

Aktivizācijas enerģija ir šķērslis reakcijas norisei, un tā ir nepieciešama, lai pārrautu reaģentu saites. Līdz ar to notiek reakcija un tiek izveidoti jauni savienojumi produktu veidošanai.
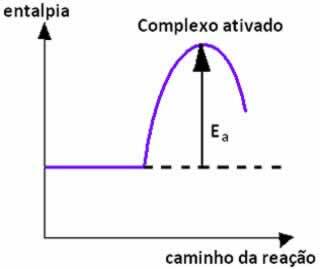
Kad labvēlīgas orientācijas reaģentu daļiņu sadursme notiek ar vienādu enerģiju vai augstāka par aktivācijas enerģiju, pirms produktu veidošanās veidojas starpposma un nestabils stāvoklis, denominēts komplekss aktivizēts, kurā reaģenta saites ir vājinātas un veidojas produktu saites. Tādējādi aktivācijas enerģija ir enerģija, kas nepieciešama aktivētā kompleksa veidošanai.
Zemāk mums ir grafiks, kas parāda aktivācijas enerģiju kā barjeru reakcijas norisei:
Autore Jennifer Fogaça
Beidzis ķīmiju
Vai vēlaties atsaukties uz šo tekstu skolas vai akadēmiskajā darbā? Skaties:
FOGAÇA, Jennifer Rocha Vargas. "Aktivizācijas enerģija"; Brazīlijas skola. Pieejams: https://brasilescola.uol.com.br/quimica/energia-ativacao.htm. Piekļuve 2021. gada 27. jūnijam.



