Jūs aldehīdi un ketoniem tās ir ļoti līdzīgas organiskās funkcijas. Abiem savā struktūrā ir karbonilfunkcionālā grupa (C = O), ar vienīgo atšķirību, kas ir aldehīdi, tas vienmēr parādās oglekļa ķēdes galā, tas ir, viens no karboniloglekļa ligandiem ir ūdeņradis; ketoniem ir karbonilgrupa starp diviem citiem oglekļa atomiem.
Aldehīdu funkcionālā grupa:Ketonu funkcionālā grupa:
O O
║ ║
C C - H C C ─ C
Šī iemesla dēļ pastāv funkcionāla izomērija starp aldehīdiem un ketoniem. Piemēram, zemāk mēs parādīsim divus funkcionālos izomērus, kuriem ir vienāda molekulārā formula (C3H6O), bet viens ir aldehīds (propanāls), bet otrs ir ketons (propanons). Uzziniet, kā tas pilnībā maina viņu īpašības un pielietojumu:
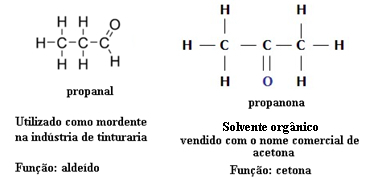
Funkcijas izomērijas piemērs starp aldehīdu un ketonu
Iedomājieties, ka atrodaties laboratorijā un atrodat flakonu ar bezkrāsainu šķidrumu, kuram ir tikai molekulārā formula C3H6O. Ko jūs darītu, lai uzzinātu, vai tas ir ketons vai aldehīds?
Lai atrisinātu šādas problēmas, ir metodes aldehīdu un ketonu diferencēšanai, pamatojoties uz šo savienojumu reakciju pret vājiem oksidētājiem
. Kā parādīts zemāk, saskaroties ar vājiem oksidētājiem, aldehīdi reaģē oksidējoties, bet ketoni nereaģē. Mēs to sakāmaldehīdi darbojas kā reducētāji, bet ketoni nedarbojas, tie reaģē tikai kā reducētāji, nonākot saskarē ar enerģētiskajiem oksidētājiem.Aldehīdi + vāji oksidētāji → karbonskābe
O O
║ ║
C ─ C ─ H + [O] → C ─ C ─ OH
Ketoni + vāji oksidētāji → Nereaģē
O
║
C ─ C ─ C + [O] → Reakcija nenotiek
Pamatojoties uz to, tad ir pietiekami veikt šo reakciju un redzēt, vai savienojums reaģē vai nē. Ja tas reaģē, mēs zinām, ka tas ir aldehīds; ja tas nereaģē, tas ir ketons.
Turklāt produkti, kas veidojas šajās aldehīda oksidēšanās reakcijās, ir diezgan redzami, mainoties krāsai, kā tiks parādīts vēlāk.
Ir trīs galvenās aldehīdu un ketonu diferencēšanas metodes:
1 - Tollens reaktīvs: Šis reaģents ir a sudraba nitrāta amonjaka šķīdums, ti, tas satur sudraba nitrātu (AgNO3) un amonija hidroksīda (NH4OH):
AgNO3 + 3 NH4OH → Ag (NH3) OH + NH4PIE3 + 2 H2O
Tollens Reactive (nosaukts vācu ķīmiķa Bernharda Tollensa (1841-1918) vārdā)
Kā paskaidrots tekstā Sudraba spoguļa izgatavošana, kad aldehīds nonāk saskarē ar Tollens reaktīvo, tas tiek oksidēts līdz attiecīgajai karbonskābei, bet sudraba joni reducējas līdz Ag0 (metālisks sudrabs). Ja šo reakciju veic, piemēram, mēģenē, šis metāla sudrabs nogulsnējas uz mēģenes sienām, kā rezultātā veidojas plēve, ko sauc par sudraba spogulis. Šis novērotais rezultāts ir ļoti skaists un tiek izmantots industriālo spoguļu ražošanas procesā.
Nepārtrauciet tūlīt... Pēc reklāmas ir vēl vairāk;)
Notiekošo reakciju var attēlot šādi:
O O
║ ║
R - C - H + H2O → R ─ C ─ OH + 2e- + 2 H+
2 Ag+ + 2e- → 2 Ag0
2 NH3 + 2 H+ → 2 NH4+
O O
║║
R C - H + 2 Ag+ + 2 NH3 + H2O → R C - OH + 2 Ag0 + 2 NH4+
aldehīds Tollens reaktīvskarbonskābe metālisks sudrabs (sudraba spogulis)
No otras puses, ja mēs ievietojam ketonu reaģēt ar Tollens reaktīvo, metāla sudraba veidošanās nenotiks, jo ketoni nespēj samazināt Ag jonus.+.
2 - Fehling reaktīvs: Šis reaktīvais ir vara sulfāta II (CuSO4) bāziskā vidē, jo to sajauc ar citu šķīdumu, ko veido nātrija hidroksīds (NaOH) un nātrija un kālija tartrāts (NaOOC-CHOH-CHOH-COOK). Vara II sulfāta šķīdumam pievieno tartrātu, lai to stabilizētu un novērstu tā nokrišņus.
KUSO4 + 2 NaOH → Na2TIKAI4 + Ku (OH)2
Fehling Reactive (nosaukts vācu ķīmiķa Hermaņa fon Fēlinga (1812-1885) vārdā)
Saskarē ar Fēlinga reaktīvo, aldehīds oksidējoties veido karbonskābi, bet vara joni (Cu)2+), kas atrodas vidū, samazinās, veidojot sarkanbrūnas nogulsnes (vairāk ķieģeļu līdzīgas krāsas), kas ir vara oksīds. Savukārt ketoni nereaģē - jo tie nespēj samazināt kujonus2+.
O O
║ ║
R - C - H + 2 Ku (OH)2 → R ─ C ─ OH + Ass2O + 2 H2O
aldehīds sarkanbrūnas nogulsnes
3- Benedikta reaktīvais: Šo reaktīvo veido arī vara II sulfāta (Cu (OH) šķīdums2) bāzes barotnē, bet to sajauc ar nātrija citrātu.
Tāpat kā ar Fēlinga reaģentu, arī aldehīda un Benedikta reaģenta reakcijas gadījumā ir arī vara joni (Cu2+), kas atrodas barotnē, kas ir reducēts un veido sarkano vara oksīdu.
Šo reaģentu plaši izmanto testos, lai noteiktu glikozes klātbūtni un saturu urīnā. Glikozes struktūrā ir aldehīda grupa, tāpēc tā reaģē ar Benedikta reaģentu, kas šajos testos atrodas sloksnēs. No turienes vienkārši salīdziniet lentes krāsu ar skalas krāsu uz produkta iepakojuma.

Benedikta reaģentu izmanto, lai noteiktu glikozes saturu urīnā.
Autore Jennifer Fogaça
Beidzis ķīmiju
Vai vēlaties atsaukties uz šo tekstu skolas vai akadēmiskajā darbā? Skaties:
FOGAÇA, Jennifer Rocha Vargas. "Aldehīdu un ketonu diferenciācija"; Brazīlijas skola. Pieejams: https://brasilescola.uol.com.br/quimica/diferenciacao-aldeidos-cetonas.htm. Piekļuve 2021. gada 27. jūnijam.
Ķīmija

Aldehīdi, karbonil savienojumi, karbonilgrupa, Galvenie aldehīdi, Etanāls, izejvielas pesticīdu un zāļu rūpniecībā, Metanāls, formaldehīda, plastmasas un sveķu rūpniecība
Ķīmija

Ketoni, organiskās vielas, karbonilfunkcionālā grupa, iegūstot emaljas šķīdinātāju, propanonu, ketona ķermeņi asinīs, eļļu un tauku ekstrakcija no augu sēklām, šķīdinātāji Organisks.



