Enerģijas oksidēšanās alkīni ir organiska reakcija, kas notiek, ja skābā šķīdumā ar šķīdumu pievieno alkīnu (ogļūdeņražu, kuram ir trīskārša saite starp diviem ogļiem). reaģents baeyer (Kālija permanganāts - KMnO4).
PIEZĪME enerģijas oksidēšana var veikt ar kālija dihromātu (K2Kr2O7), un ne tikai kālija permanganāts.
Ikreiz, kad no tiek veikta enerģētiskā oksidēšana alkīnos, ir produkti, kuru izcelsme var būt karbonskābes, ūdens (vienīgais priekšmets, kas parādās jebkurā no tiem) un oglekļa dioksīds (CO2).
Baeyer reaģents skābā vidē
Ja Baeyer reaģentu sajauc ar ūdeni, a klātbūtnē skābe (viela, kas spēj izdalīt H jonus+), divu veidošanās oksīdi (kālija oksīds un mangāna oksīds II) un topošie oksigēni ([O]).

Enerģijas oksidēšanās mehānismi alkīnos
1. mehānisms: pārtraucot trīskāršo saiti.
Sākotnēji trīskāršajai saitei uzbrūk topošie oksigēni, ko veido Baijera reaģents. Šis uzbrukums izraisa trīskāršās saites pilnīgu pārtraukumu.
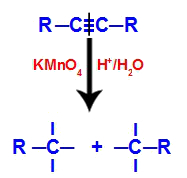
Trīskāršās saites pārtraukšana ar topošo oksigēnu uzbrukumu
Kad trīskāršā saite tiek pārtraukta, alkīns tiek sadalīts divās daļās. Uz katra no trīskāršajiem oglekļiem parādās trīs brīvās valences.
2. mehānisms: Hidroksilgrupu mijiedarbība
Katru brīvo valenci uz oglekļiem, kur bija trīskāršā saite, aizņem hidroksilgrupas (OH), veidojot poliolu (alkohols ar vairākiem hidroksiliem).
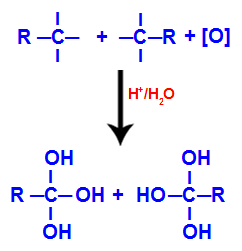
Poliola veidošanās ar hidroksilgrupām pēc trīskāršās saites šķelšanās
PIEZĪME: Ja ogleklim, kur agrāk bija trīskāršā saite, ir pievienots ūdeņraža atoms, šis ūdeņraža atoms saņems topošo skābekli un arī veidos citu hidroksilu.
3. mehānisms: Ūdens molekulu veidošanās
Ja ogleklim ir divas vai vairākas OH grupas, tas ārkārtīgi klātbūtnes dēļ kļūst par ļoti nestabilu struktūru elektronegatīvi. Tādējādi nestabilitātes dēļ molekula tiek dehidrēta, tas ir, hidroksils saistās ar hidroniju (H+) no cita hidroksilgrupa un veido ūdeni.

Ūdens molekulu veidošanās no diviem hidroksiliem, kas atrodas izveidotajā poliolā
Nepārtrauciet tūlīt... Pēc reklāmas ir vairāk;)
4. mehānisms: Produkta veidošana
Pēc ūdens molekulu veidošanās ogleklis zaudē saiti a izejas dēļ hidroksilgrupa, un otra hidroksila skābeklis arī zaudē saiti, kas tika izveidota ar a ūdeņradis. Tāpēc starp šo oglekli un skābekli parādās dubultā saite, kas veido karbonilu (C = O) un stabilizē abus.
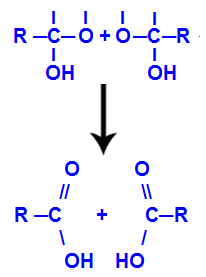
Karbonilgrupa divās struktūrās, kas iegūtas no alkīna
Alķīna enerģijas oksidācijas vienādojuma piemērs
Piemērs: But-1-ino enerģētiskā oksidēšana
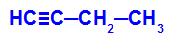
But-1-yna strukturālā formula
Kad but-1-ievu ievieto barotnē, kurā ir Baiera reaģents, ūdens un skābe, saite saplīst. trīskāršs starp 1. un 2. ogli, pateicoties topošajiem oksigeniem, kas pastāv vidū, kā vienādojumā zemāk:
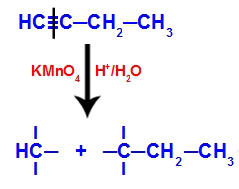
But-1-yne savienojumu pārtraukšana
Pēc tam, kad trīskāršā saite ir sadalīta, 1. un 2. ogleklis saņem trīs hidroksilgrupas, bet oglekļa 1 būs vēl viens, jo tam bija ūdeņraža atoms (kas saistās ar topošo skābekli), veidojot divus poliolus (1. un 2. fragments).

Vienādojums, kas attēlo poliolu veidošanos
Drīz pēc tam, kad polioli ir nestabili, mums no hidroksiliem veidojas ūdens molekulas. 1. fragmentā parādās ūdens molekula (jo ir trīs hidroksilgrupas) un 2. fragmentā parādās divas molekulas (jo ir četri hidroksili).
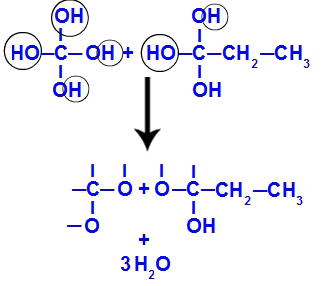
Ūdens molekulu veidošanās no but-1-yne fragmentiem
Visbeidzot, mums ir izveidojusies dubultā saite starp ogļūdeņražiem, kas zaudējuši hidroksilu, un oksigeniem, kas zaudējuši ūdeņradi, kā rezultātā rodas karbonilgrupas.

Karbonilgrupu veidošanās but-1-yna fragmentos
Izmantojot iepriekšējo vienādojumu, mēs varam redzēt, ka but-1-yns radīja karbonskābi un oglekļa dioksīdu (CO2).
Autors: Diogo Lopes Dias
Vai vēlaties atsaukties uz šo tekstu skolas vai akadēmiskajā darbā? Skaties:
DIENAS, Diogo Lopes. "Enerģijas oksidēšana alkīnos"; Brazīlijas skola. Pieejams: https://brasilescola.uol.com.br/quimica/oxidacao-energetica-alcinos.htm. Piekļuve 2021. gada 28. jūnijam.
Alkīni, ētiskie ogļūdeņraži, acetilēnogļūdeņraži, acikliskā oglekļa ķēde, oglekļa ķēde viendabīga, nepiesātināta oglekļa ķēde, trīskāršā saite, PVC, PVA, acetilēns, sintētiskās gumijas, plastmasa, stieples tekstilizstrādājumi.

