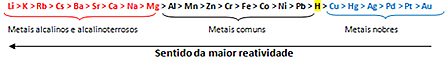
O subalansuojant oksidacijos-redukcijos lygtį jis pagrįstas atiduotų elektronų skaičiaus ir gaunamų elektronų skaičiaus lygybe. Paprastas šio balansavimo metodas yra toks:
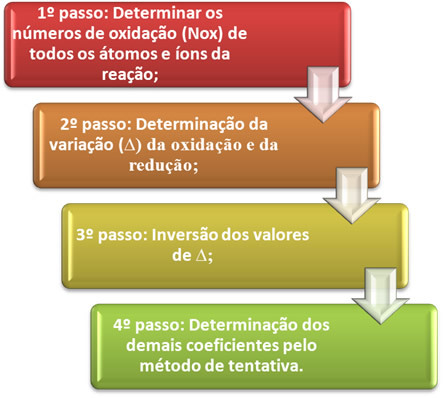
Pažiūrėkime praktiškai, kaip taikyti šiuos veiksmus, naudodami šį pavyzdį:
Reakcija tarp vandeninio kalio permanganato tirpalo ir druskos rūgšties:
kmnO4 + HCl → KCl + MnCl2 + Cl2 + H2O
*1-as žingsnis:Nustatykite oksidacijos skaičius:
Šis žingsnis yra svarbus, nes paprastai negalime greitai įsivaizduoti, kurios rūšys oksiduojasi ir redukuojasi.
+1 +7 -2 +1 -1 +1 -1 +2 -1 0 +1 -2
kmnO4 + HCl → KCl + MnCl2 + Cl2 + H2O
*2 žingsnis:Oksidacijos ir redukcijos kitimo nustatymas:

Atkreipkite dėmesį, kad manganas (Mn) redukuojamas, o chloras (Cl) yra oksiduojamas.
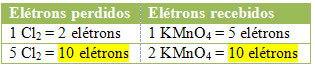
MnCl2 = ∆Nox = 5
Cl2 = ∆Nox = 2
Chloro atveju galime pažymėti, kad HCl sudarė 3 junginius (KCl, MnCl2ir Cl2), bet mus domina Cl2, nes jūsų Noksas patyrė variacijų. Kiekvienas chloras, kuris sudaro Cl2 prarasti 1 elektroną; nes kiekvienam Cl susidaryti reikia 2 chlorų2, tada prarandami du elektronai.
3 žingsnis:∆ reikšmių inversija:
Šiame etape ∆ reikšmės keičiamos tarp minėtų rūšių ir tampa jų koeficientais:
MnCl2 = ∆Nox = 5 → 5 bus Cl koeficientas2
Cl2 = ∆Nox = 2→ 2 bus MnCl koeficientas2
kmnO4 + HCl → KCl + 2 MnCl2 + 5 Cl2 + H2O
Šiuo metu jau galima žinoti du lygties koeficientus.
Stebėjimas: paprastai daugumoje reakcijų šis vertybių pakeitimas atliekamas 1-ajam nariui. Tačiau paprastai tai turėtų būti daroma tame naryje, kuris turi daugiausiai atomų, kuriems įvyksta redoksas. Jei šio kriterijaus neįmanoma įvykdyti, mes apversime narių, turinčių didžiausią cheminių medžiagų skaičių, reikšmes. Tai buvo padaryta čia, nes 2-asis narys turi daugiau medžiagų.
Nesustokite dabar... Po reklamos yra daugiau;)
4 žingsnis: Bandymo balansavimas:
kmnO4 + HCl → KCl + 2 MnCl2 + 5 Cl2 + H2O
- Kadangi antrame naryje yra du mangano atomai, kaip parodo koeficientas, pirmajame taip pat turi būti. Taigi mes turime:
2 kmnO4 + HCl → KCl + 2 MnCl2 + 5 Cl2 + H2O
- Taigi kalio (K) kiekis 1-ame naryje buvo 2, o tai bus tas pats koeficientas šiam antrojo nario atomui:
2 kmnO4 + HCl → 2 KCl + 2 MnCl2 + 5 Cl2 + H2O
- Chloro (Cl) kiekis 2-ame naryje yra 16, taigi 1-ojo nario HCl koeficientas bus:
2 kmnO4 + 16 HCl → 2 KCl + 2 MnCl2 + 5 Cl2 + H2O
- Vandenilių skaičius 1-ame naryje yra 16, taigi ir vandens koeficientas (H22-ojo nario O) bus lygus 8, nes vandenilio indekso (2) padauginimas iš 8 yra lygus 16:
2 kmnO4 + 16 HCl → 2 KCl + 2 MnCl2 + 5 Cl2 + 8 H2O
- Norėdami patikrinti, ar lygtis tinkamai subalansuota, galime pamatyti du kriterijus:
1) Patikrinkite, ar kiekvieno atomo kiekis dviejuose nariuose yra lygus:
2 kmnO4 + 16 HCl →2 KCl + 2 MnCl2 + 5 Cl2 + 8 H2O
K = 2K = 2
Mn = 2 Mn = 2
Cl = 16 Cl = 16
H = 16 H = 16
O = 8 O = 8
2) Pažiūrėkite, ar bendras prarastų elektronų skaičius yra lygus bendram gautų elektronų skaičiui:
Jennifer Fogaça
Baigė chemiją
Ar norėtumėte paminėti šį tekstą mokykloje ar akademiniame darbe? Pažvelk:
FOGAÇA, Jennifer Rocha Vargas. „Roxi redukcijos balansavimas“; Brazilijos mokykla. Yra: https://brasilescola.uol.com.br/quimica/balanceamento-por-oxirreducao.htm. Žiūrėta 2021 m. Birželio 28 d.