Fizikinėje chemijoje daugiausia tiriamos oksidacijos-redukcijos reakcijos, kuriose vyksta elektronų pernaša. Reaguojančios rūšys (atomas, jonas ar molekulė), kurios netenka vieno ar daugiau elektronų, yra tos, kurios oksiduojasi. Kita vertus, cheminių medžiagų, priimančių elektronus, rūšys yra sumažėjusios.
Paprastai, kai tokio tipo reakcijos tiriamos neorganinėje chemijoje, ji vadinama paprasta mainų reakcija arba poslinkio.
Norint įvykti bet kokia reakcija, būtina įvykdyti tam tikras sąlygas. Vienas iš jų yra tas, kad turi būti cheminis giminingumas tarp reagentų, tai yra, jie turi sąveikauti taip, kad susidarytų naujos medžiagos.
Redokso reakcijų atveju afinitetas reiškia, kad vienas iš reagentų linkęs įgyti elektronus, o kitas - elektronus. Ši tendencija atitinka reaktyvumas cheminių elementų.
Pažiūrėkime, kaip galima palyginti metalų reaktyvumą.
Tarkime, kad mes norime laikyti vario II sulfato tirpalą (CuSO4). Mes niekaip negalėjome įdėti šio tirpalo į aliuminio indą, nes įvyktų tokia reakcija:
2 Als + 3 CuSO4 (aq)→ 3 kubs + Al2(TIK4)3 (aq)
Atkreipkite dėmesį, kad aliuminis oksidavosi, prarado po 3 elektronus ir tapo aliuminio katijonu:
Als → Al3+(čia) + 3 ir-
Tuo pačiu metu vario katijonas (Cu2+), kuris buvo tirpale, gavo aliuminio elektronus ir redukavo, tapdamas metaliniu variu. Kiekvienas vario katijonas gauna du elektronus:
Asilas2+(čia) + 2 ir- → Cus
Tačiau jei būtų atvirkščiai ir norėtume laikyti aliuminio sulfato tirpalą (Al2(TIK4)3 (aq)), tai nebūtų problema įdėti jį į vario indą, nes ši reakcija neįvyks:
Asilass + Al2(TIK4)3 (aq) → neatsiranda
Šiuos pastebėtus faktus galima paaiškinti tuo, kad aliuminis yra reaktyvesnis nei varis.
Metalai turi polinkį atsisakyti elektronų, tai yra oksiduotis. Lyginant įvairius metalus, tas, kuris turi didžiausią polinkį aukoti elektronus, yra pats reaktyviausias. Taigi metalų reaktyvumas taip pat siejamas su jų jonizacijos energija, tai yra, mažiausia energija, reikalinga elektronui pašalinti iš dujinio atomo, esant jo pagrindinei būsenai.
Nesustokite dabar... Po reklamos yra daugiau;)

Remiantis tuo, metalo reaktyvumo eilė arba elektrolitinių įtampų eilė, nurodyta apačioje:
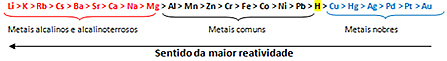
Labiausiai reaktyvus metalas reaguoja su joninėmis medžiagomis, kurių katijonai yra mažiau reaktyvūs. Kitaip tariant, kairėje esantis metalas reaguoja su medžiaga, kurią sudaro jos dešinėje esantys jonai. Priešingai nenutinka.
Prisimindami pateiktą pavyzdį, reaktyvumo eilutėje pamatykite, kad aliuminis (Al) yra kairėje nuo vario (Cu). Todėl aliuminis reaguoja su vario katijonų susidariusiu tirpalu; bet varis nereaguoja su tirpalu, susidariusiu iš aliuminio katijonų.
Atkreipkite dėmesį, kad reaktyviausias metalas yra ličio (Li), o mažiausiai - aukso (Au).

Tai yra viena iš priežasčių, kodėl auksas yra toks vertingas, nes jei jis nereaguoja, jis ilgai lieka nepakitęs. Tai matyti iš auksu padengtų Egipto sarkofagų ir skulptūrų, kurios datuojamos tolimiausioje senovėje. Tai mes taip pat įsivaizduojame lygindami gryno aukso papuošalų ilgaamžiškumą su papuošalais, pagamintais iš kitų metalų, kurie yra labiau reaktyvūs nei auksas.

Jennifer Fogaça
Baigė chemiją
Ar norėtumėte paminėti šį tekstą mokykloje ar akademiniame darbe? Pažvelk:
FOGAÇA, Jennifer Rocha Vargas. „Metalų reaktyvumo tvarka“; Brazilijos mokykla. Yra: https://brasilescola.uol.com.br/quimica/ordem-reatividade-dos-metais.htm. Žiūrėta 2021 m. Birželio 28 d.

