Poslinkio reakcijos, taip pat vadinama pakaitinės reakcijosar vis dar iš paprastas keitimasis, yra tie, kurie atsiranda, kai paprasta medžiaga (suformuota vieno elemento) reaguoja su sudėtine medžiaga, pastarąją „išstumdama“ į naują paprastą medžiagą.
Paprastai mes galime jį apibrėžti taip:
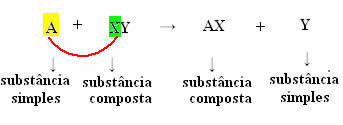
Bet kad tai įvyktų, paprasta medžiaga, A simbolizuojamu atveju, turi būti reaktyvesnis už elementą, kuris bus išstumtas iš junginio, transformuodamas save į naują paprastą substanciją (Y).
Pažvelkime į šios reakcijos pavyzdį:
Stebėkite toliau pateiktą eksperimentą, kai cinko lakštas (Zn) dedamas į vandeninį vario sulfato tirpalą (CuSO4). Laikui bėgant pažymima, kad vario sulfato tirpalas iš mėlynos spalvos pasikeičia į mažiau intensyvią mėlyną, nes spalva pasikeitė ir ant cinko lakšto buvo vario nuosėdų.

Mes galime parodyti šią reakciją naudodami šią cheminę lygtį:

Atkreipkite dėmesį, kad cinkas išstūmė varį, o tai reiškia, kad cinkas yra labiausiai reaktingas.
Kadangi abu yra metalai, galime patikrinti, ar bus paprasta mainų reakcija, analizuodami metalo reaktyvumo eilė nurodyta apačioje:
Nesustokite dabar... Po reklamos yra daugiau;)

Atkreipkite dėmesį, kad varis iš tikrųjų yra mažiau reaktyvus nei cinkas, taigi, jei mes nusprendėme padaryti priešingai nei ankstesnis eksperimentas ir įdėjus vario lakštą į cinko sulfato tirpalą, reakcija neįvyks, nes varis negalės išstumti cinkas.
Poslinkio reakcijos yra tam tikra redoksinės reakcijos rūšis, nes vyksta elektronų perkėlimas iš paprastos medžiagos į sudėtinę medžiagą. Pirmiau paaiškinto proceso metu cinkas iš pradžių buvo neutralios formos, kuris yra metalinis, ir tapo junginio, kuriame jis turi 2+ krūvį, dalimi, tai yra, kiekvienas cinko atomas prarado du elektronai. Naudojant varį, vyksta atvirkščiai, jis gauna du elektronus, kurie pereina į metalinę kietąją būseną.
Atliekant paprastą mainų reakciją su nemetalais, laikoma: reakcija įvyks tik tuo atveju, jei reaktyviausias nemetalas yra paprasta medžiaga, galinti išstumti kitą mažiau reaktyvų nemetalą. Ametalų reaktyvumas parodytas žemiau:

Jennifer Fogaça
Baigė chemiją
Ar norėtumėte paminėti šį tekstą mokykloje ar akademiniame darbe? Pažvelk:
FOGAÇA, Jennifer Rocha Vargas. "Perkėlimas, pakeitimas ar paprastos mainų reakcijos"; Brazilijos mokykla. Yra: https://brasilescola.uol.com.br/quimica/reacoes-deslocamento-substituicao-ou-simples-troca.htm. Žiūrėta 2021 m. Birželio 28 d.


