Amerikiečių chemikas Gilbertas N. Lewisas (1875–1946) pasiūlė okteto taisyklę, kurioje sakoma:
"Įvairių elementų atomai užmezga chemines jungtis, dovanodami, priimdami ar dalindamiesi elektronais, kad gautų elektroninę konfigūraciją tauriųjų dujų, tai yra su 8 elektronais paskutiniame apvalkale (arba su 2 elektronais tų atomų atveju, kurie turi tik vieną elektronų apvalkalą, kaip būna vandenilis). "
1916 m. Lewisas pasiūlė išlikti stabiliam ir pasiekti oktetą ar duetą - elementus, kurie sudaro molekulinės medžiagos atlikti dalijimąsi elektronų poromis. Šios medžiagos susidaro tik vandenilis, nemetalai ir pusmetalai, visi su polinkis priimti elektronus. Todėl nė vienas iš jų negali paaukoti jokio elektrono (kaip būna metalams esant joniniams ryšiams), tačiau visi turi gauti, todėl jie dalijasi savo elektronais per kovalentinį ryšį arba molekulinė.
Taigi, Gilbertas Lewisas pasiūlė kovalentinį arba molekulinį ryšį, kuris tapo žinomas kaip Lewiso formulė. Ji taip pat vadinama elektroninė formulė
ar dar, Elektroninė Lewiso formulė, nes pagrindinis jo bruožas yra tas, kad jis parodo kiekvieno atomo valentinio apvalkalo elektronus ir elektroninių porų susidarymą.Kiekvieną elektroną žymi taškas., kuris supa atitinkamo cheminio elemento simbolį. Aplink elementą yra tik valentinio apvalkalo elektronai.
Kaip parodyta žemiau esančioje lentelėje, norėdami sužinoti elektronų kiekį valentiniame apvalkale, tiesiog žinokite periodinių lentelių šeimą:
Nesustokite dabar... Po reklamos yra daugiau;)

Lewiso formulėje kiekviena bendra elektronų pora reiškia cheminį (kovalentinį) ryšį, kur elektronai susitinka elektrosferos srityje, kuri yra bendra kiekvienai sujungtų atomų porai. Todėl reprezentacijoje jie dedami vienas šalia kito.
Pavyzdžiui, išsiaiškinkime, kokia yra Lewiso formulė vandenilio dujoms, kurių molekulinė formulė yra: H2.
Kiekvieno vandenilio atomo valentiniame apvalkale yra tik vienas elektronas, nes šis elementas priklauso periodinės lentelės 1 šeimai. Kiekvienas turi gauti dar vieną elektroną, kad jis būtų stabilus, o K elektronų apvalkale būtų du elektronai. Taigi jie dalijasi savo elektronais ir abu gauna du. Pažvelk:
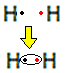
Tai yra vandenilio dujų molekulės Lewiso formulė.
Deguonies elektronų apvalkale yra šeši elektronai, todėl kiekvienas turi gauti dar du elektronus, kad būtų stabilūs, su aštuoniais elektronais. Todėl deguonies dujų molekulės Lewiso formulė yra:

Pažiūrėkite, ar yra dvi nuorodos, nes yra dvi bendros poros.
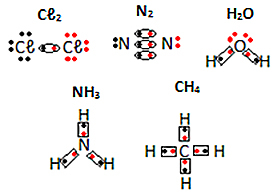
Žr. Kitus elektroninių molekulinių medžiagų formulių pavyzdžius žemiau:
Jennifer Fogaça
Baigė chemiją
Ar norėtumėte paminėti šį tekstą mokykloje ar akademiniame darbe? Pažvelk:
FOGAÇA, Jennifer Rocha Vargas. „Lewis elektroninė formulė“; Brazilijos mokykla. Yra: https://brasilescola.uol.com.br/quimica/formula-eletronica-lewis.htm. Žiūrėta 2021 m. Birželio 28 d.
Anglies erdvinė formulė, „Lewis“ elektroninė formulė, plokštumos struktūra, elektroninės poros, ryšys kovalentinis, valentinis sluoksnis, atomo modelio raida, molekulinė formulė, struktūrinė formulė, formulės trimatis.
Cheminės formulės, plokščios struktūrinės formulės, jungties struktūrinė formulė, triguba jungtis, dujos azotas, elektroninė formulė, Lewiso formulė, molekulinė formulė, viengubas ryšys, dvigubas ryšys, dujos anglies.
Chemija
Molekulinės medžiagos, virimo temperatūra, kontaktinis paviršius, virimo temperatūra, tarpmolekulinės traukos jėgos, cheminiai ryšiai, molekuliniai junginiai, kovalentiniai cheminiai ryšiai, joninės jungtys, metalinės jungtys, fizikinės jungties būsenos blogai