auto-oxi redukcija arba neproporcinga reakcija yra redokso reakcijos tipas, kurio metu vyksta tas pats cheminis elementas oksidacija ir redukcija. Pažvelkime į du tokio tipo reakcijos pavyzdžius ir kaip juos subalansuoti naudojant redokso metodą:
1-as pavyzdys:
PRIE2- + H+ → NE3- + NE + H2O
- Apskaičiavus visų reakcijoje dalyvaujančių atomų ir jonų oksidacijos skaičius (NOX), galima patikrinti, kas oksidavosi ir kas sureagavo:
+3 -2 +1 +5 -2 +2 -2 +1 -2
PRIE2- + H+ → NE3- + NE + H2O
- Atkreipkite dėmesį, kad azotas buvo rūšis, kuri ir reagavo, ir oksidavosi:
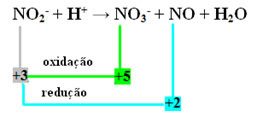
- Norėdami atlikti šios reakcijos pusiausvyros pusiausvyrą, NOX turime susieti su produktais, o ne su reagentais:
PRIE3- = ∆Nox = 5 - 3 = 2
NO = ∆Nox = 3 - 2 = 1
- Apversdami ∆NOX koeficientais, turime:
PRIE3- = ONOX = 2 → 2 bus NO koeficientas
NE = ONOX = 1→ 1 bus NO koeficientas3-
PRIE2- + H+ → 1 PRIE3- + 2 NO + H2O
- Tai mes jau žinome, kad produkte yra 3 N, taigi NO koeficientas2- bus 3:
3 NE2- + H+ → 1 NE3- + 2 NO + H2O
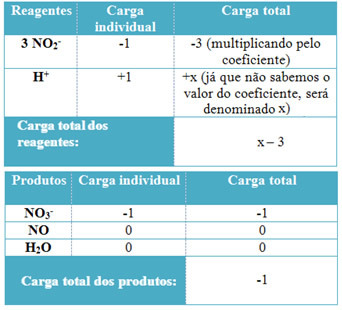
- Norint nustatyti H koeficientus+ ir iš H2O, prisimink, kad gautų elektronų skaičius yra lygus tokiam pačiam paaukotam elektronų kiekiui; taigi reagento įkrova bus lygi produkto įkrovai. Tokiu būdu galime sukurti šią schemą:
Nesustokite dabar... Po reklamos yra daugiau;)
Remiantis šia informacija turime, kad bendras reagentų krūvis yra lygus x - 3 o produktas lygus -1. Kaip minėta, judviejų mokesčiai turi būti vienodi. Kadangi jau turime visą produktų kiekį, galime atlikti paprastą skaičiavimą, kad žinotume, kokia bus x reikšmė:
x -3 = -1
x = -1 +3
x = 2
Taigi H koeficientas+ yra 2, taigi ir H2Bus 1:
3 NE2- + 2 H+ → 1 NE3- + 2 NO + 1 H2O
2-as pavyzdys:
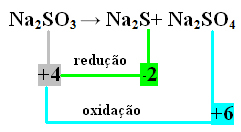
Šiuo atveju redukciją ir oksidaciją vienu metu patyrė S. Taigi, kaip buvo padaryta anksčiau, mes galime susieti NOX su produktais ir apversti jų vertes, priskirdami jiems koeficientus:
At2 S = ∆Nox = 4 - (-2) = 6 → 6 bus Na koeficientas2 TIK4
At2 TIK4= ∆Nox = 6 - 4 = 2 → 2 bus Na koeficientas2 s
At2 TIK3→ 2 At2 Y + 6 At2 TIK4
Kadangi 2 galūnėje yra 8 sieros, Na koeficientas2 TIK3 bus 8:
8 įėjimas2 TIK3→ 2 įėjimai2 S + 6 colių2 TIK4
Jennifer Fogaça
Baigė chemiją
Ar norėtumėte paminėti šį tekstą mokykloje ar akademiniame darbe? Pažvelk:
FOGAÇA, Jennifer Rocha Vargas. „Savaime oksiduojančios reakcijos“; Brazilijos mokykla. Yra: https://brasilescola.uol.com.br/quimica/reacoes-auto-oxirreducao.htm. Žiūrėta 2021 m. Birželio 28 d.
