Hidrinimas vyksta nesočiųjų aciklinių angliavandenilių, tai yra, turinčių atviras grandines su dvigubais arba trigubais ryšiais, tokiais kaip alkenai, alkinai ir dienai. Jis taip pat gali pasireikšti aromatiniuose angliavandeniliuose, nes jie turi dvigubus ryšius žiede ir su ciklanais (cikloalkanais) iki penkių anglių.
Šie junginiai, kaitindami, reaguoja kaip vandenilio dujos, dalyvaujant kai kuriems katalizatoriams, tokiems kaip nikelis, platina ir paladis. Taigi įvyksta adicijos reakcija, kai pi (π) ryšys nutrūksta, susidaro dvi naujos viengubos jungtys ir į molekulę įvedamas vandenilis.
Paprastai mes turime:
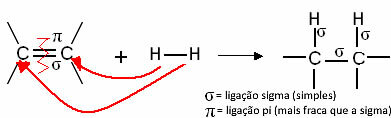
Bendroji hidrinimo reakcija
Dabar pažvelkime į keletą pavyzdžių:
- Hidrinimas iki alkenų: Gautas produktas yra alkanas.
Žemiau turime etileno (arba etileno) hidrinimo reakciją, kad gautume etaną:
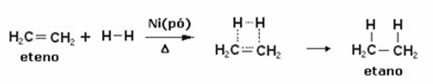
Etileno hidrinimo reakcijos pavyzdys
Tokio tipo katalizinį hidrinimą maisto pramonė naudoja pusiau kietiems riebalams, tokiems kaip margarinai. Augaliniai aliejai ir riebalai skiriasi tik tuo, kad aliejai turi ilgas molekules tarp anglies turi dvigubus ryšius, o riebalai tarp jų turi tik viengubus ryšius anglies.
Taigi, norint paversti aliejų riebalais, pakanka aliejų hidrinti. Tokiu būdu jūsų dvigubos obligacijos bus suskaidytos ir konvertuojamos į vienkartines obligacijas. Rezultatas yra skambučių gamyba hidrinti augaliniai riebalai.
- Alkinų hidrinimas: Kadangi alkinai turi du pi ryšius, jų visiškas hidrinimas vyksta dviem etapais, pirmame susidaro alkenas, o antrame - alkanas.
Žemiau pateiktoje reakcijoje turime propino hidrinimą galutiniu propano susidarymu:
1 žingsnis: H3C C ≡ CH + H2 → H3C CH═ ÇH2
2 etapas: H3C CH═ ÇH2 + 2 valandos2 → H3C CH2─ ÇH3
Jei norime, kad ši reakcija sustotų pirmajame etape, turime naudoti medžiagą, kuri sustabdo katalizatoriaus veikimą.
- Dienų hidrinimas: Yra trys dienų tipai: sukaupta (dvigubos obligacijos pasirodo žemiau), izoliuotas (dvigubas obligacijas skiria mažiausiai dvi pavienės obligacijos) ir konjugatai (dvigubos jungtys atsiranda pakaitomis).
Susikaupusių ir izoliuotų dienų hidrinimas vyksta taip pat, kaip matėme alkenams, tačiau dvigubai, nes dienai turi daugiau nesočiųjų. Žr. Du pavyzdžius:
* Hidrinimo susikaupusiame diene pavyzdys:
H H H
│ │ │
H3C CH ═ Ç ═ CH ─ CH3 + 2 valandos2 → H3C CH ─ Ç ─ CH ─ CH3
│ │ │
H H H
* Hidrinimo izoliuotame diene pavyzdys:
H H H H
│ │ │ │
H3C CH ═ CH─CH2 ─ CH ═ CH ─ CH3 +2 H2 → H3C CH ─ CH─CH2 ─ CH ─ CH ─ CH3
Kita vertus, konjuguotų dienų hidrinimas gali vykti dviem būdais: su 1,2 ir 1,4. Labiausiai paplitęs yra 1,2 papildymas, kai vandeniliai pridedami prie anglies, sudarančios dvigubą jungtį, ir esant žemai temperatūrai. Kita vertus, 1,4 papildymas vyksta esant aukštai temperatūrai ir yra tada, kai 1 ir 4 anglyse yra rezonansas ir atsiranda laisvų valentų. Žr. Kiekvieno atvejo pavyzdžius:
* 1.2 pridėjimo konjuguotose dienose pavyzdys:
H2C CH ─ CH ═ CH2 + H2 → H2C CH ─ C ─ CH CH2
│ │
H H
* 1.4 papildymo konjuguotose dienose pavyzdys:
H2C CH ─ CH ═ CH2 + H2 → H2C CH ═ CH CH2
│ │
H H
- Aromatinių medžiagų hidrinimas: Benzeno žiedo pi jungtys nutrūksta ir vandenilio atomai pridedami prie anglies junginių, kurie sukuria šias jungtis.
Šis visiško hidrinimo tipas parodytas žemiau:

Visuminė benzeno hidrinimo reakcija
- Ciklano hidrinimas: Vyksta alkano susidarymas.
Pavyzdys: ciklopropano hidrinimas:
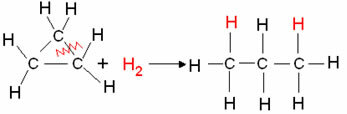
Ciklopropano hidrinimo reakcija
Jennifer Fogaça
Baigė chemiją
Šaltinis: Brazilijos mokykla - https://brasilescola.uol.com.br/quimica/reacao-organica-hidrogenacao.htm

