Tu metalai tai yra cheminiai elementai, kurių pagrindinė fizinė savybė yra gebėjimas prarasti elektronus ir dėl to susidaryti metaliniai katijonai. Dėl šios priežasties jie gali užmegzti dviejų tipų cheminius ryšius: joninį ryšį ir metalinis ryšys.
joninis ryšys atsiranda, kai metalas sąveikauja su metalinio pobūdžio elementu, kuris gali būti a ametal arba vandenilis. Šio tipo ryšyje mes turime elektronų nuostolius dėl metalų ir elektronų padidėjimą dėl nemetalų ar vandenilio.
jau metalinis ryšys yra nusistovėjęs tarp vieno metalinio elemento atomų. Šio tipo jungtis atsiranda tik tarp vieno metalo atomų ir tik todėl, kad metalas negali užmegzti cheminio ryšio su kitu skirtingu metaliniu elementu.
Bendrosios metalų charakteristikos
Kietosios medžiagos kambario temperatūroje, išskyrus gyvsidabrį;
Jie yra puikūs;
Jie turi aukštas lydymosi ir virimo temperatūras;
Paprastai jie yra sidabrinės spalvos, išskyrus auksą, auksinį, ir varį, kuris yra rausvas;
Grynus metalus sudaro atomų sankaupos (vieno cheminio elemento), vadinamos krištolo gardelėmis.
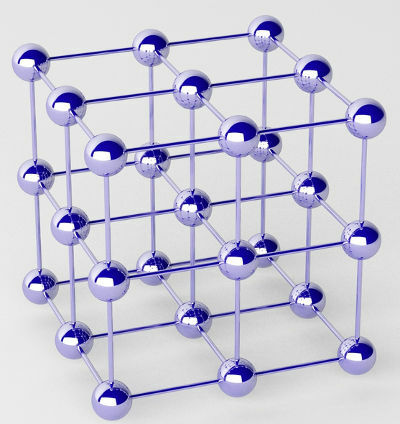
Metalo kristalinės gardelės atvaizdavimas
Metalo sujungimo principai
At metalinis ryšys, metalus sudarančios kristalinės gardelės iš tikrųjų yra jonų sankaupos (sudarytos tik iš katijonai ir elektronai). Elektronai, esantys metalų atomų valentiniame sluoksnyje, yra delokalizuojami, tai yra, jie palieka valentinį sluoksnį, todėl atomas tampa katijonu (trūksta elektronų).
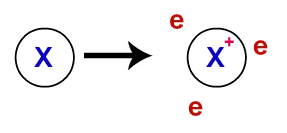
Delokalizuotų elektronų atvaizdavimas iš valentinio apvalkalo
Po delokalizacijos elektronai iš metalinių atomų pradeda juosti katijonus, formuodami tikrą „elektronų jūrą“. Kiekvienas iš jūroje esančių elektronų turi galimybę laisvai judėti per kristalinę metalo gardelę.

Elektronų jūros modelio atvaizdavimas
PASTABA: Elektronai „iš jūros“ nesugeba palikti kristalinės gardelės ir juda per ją.
Metalų savybės, pateisinamos metaliniu sujungimu
a) Kalus
Per metalą galima gaminti skirtingo storio ir lakštus. Dėl šios metalų savybės galime pastatyti įvairius daiktus, tokius kaip peiliai, kardai ir kt.

Kardo ašmenys pagaminti iš metalo
b) Laidumas
Metalai apskritai yra geri elektros srovės ir šilumos laidininkai. Kai bet kuris metalas liečiasi su šilumos šaltiniu arba elektros srovės šaltiniu, jis gali juos praleisti.

Krosnies liepsnoje esanti aliuminio keptuvė dėl laidumo tampa visiškai karšta.
c) Dalyvavimas
Per metalą galime gaminti laidus. Metalo naudojimas laidų pavidalu palengvina jo naudojimą, ypač atsižvelgiant į elektros laidumą.

Laidams gaminti gali būti naudojamas metalas, pavyzdžiui, varis.
Mano. Diogo Lopes Dias
Šaltinis: Brazilijos mokykla - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-ligacao-metalica.htm
