Atomo tūris nėra tomas, kurį užima atomas, bet nurodo tūris, kurį užima fiksuotas tam tikro cheminio elemento atomų skaičiaus kiekis.
Tekste Cheminis elementas, buvo parodyta, kad elementas atitinka atomų rinkinį, turinčią tą patį atomų skaičių, tai yra, tą patį protonų kiekį branduolyje. Atominiam tūriui apskaičiuoti nustatytas kiekis yra Avogadro konstanta, kuris lygus 6,02. 1023 atomų, kurie atitinka 1 molą elemento.
Taigi mes galime tai pasakyti atominis tūris yra tūris, kurį sudaro 1 molis atomų (arba 6,02). 1023 atomai) elemento užima.
Šį kiekį galima apskaičiuoti, jei žinome kietojo kūno elemento tankį ir 1 molio to elemento atomų masę. Pavyzdžiui, atsižvelkite į tai, kad natrio (Na) tankis yra lygus 0,97 g / cm3 ir kad 6.02. 1023 natrio atomų masė lygi 23,0 g. Tada pagal tankio formulę galime pasiekti natrio atominį tūrį. Pažiūrėkite, kaip:
tankis = makaronai
apimtis
atominis tūris = masė 6,02. 1023 elementų atomai
kietojo kūno elementų tankis
Natrio atomo tūris = 23,0 g
0,97 g / cm3
Natrio atomo tūris = 23,71 cm3
Atomo tūrio reikšmė apima ne tik atomų dydį, bet ir atstumą tarp jų. Kadangi tai taip pat apima tuščias vietas, mes negalime paimkite atomo tūrio vertę ir padalykite iš atomų skaičiaus (6.02. 1023) rasti kiekvieno atomo užimamą tūrį.
Svarbu ištirti atominį tūrį, nes jis yra periodinė savybė, tai yra, jis skiriasi priklausomai nuo elemento atominio skaičiaus. Pažvelkite į paveikslėlį žemiau. Elementų atominis tūris auga iš viršaus į apačią, o tai reiškia, kad analizuojant elementus, priklausančius tai pačiai periodinės lentelės šeimai, augant atominiam skaičiui, auga ir atominis tūris. Taip yra todėl, kad šia prasme periodai didėja, o tai reiškia, kad didėja elektroniniai atomų sluoksniai, taigi ir jų užimamas tūris. Tai tas pats augimo jausmas kaip atominis spindulys.
Kita vertus, horizontaliai matome, kad atominis tūris didėja nuo centro iki kraštų. Kai pradedame iš kairės ir einame tiesiai į periodinės lentelės vidurį, atominis tūris sumažėja, nes laikotarpis yra tas pats, tai yra, tos pačios linijos elementai turi tą patį kiekį elektroninių sluoksnių, tačiau atomo skaičius bus didėja. Tai reiškia, kad elektronų kiekis šia kryptimi didėja, o tai lemia didesnę jėgą elektronų pritraukimas prie atomo branduolio, mažinant jo atomo spindulį ir, atitinkamai, tūrį atominis. Tačiau iš centro į dešinę taip nenutinka, nes šiame regione esančių elementų atveju ypač nemetalų atveju tarpai tarp jų atomų yra gana dideli, o tai daro įtaką atomo tūriui, ją didinant.
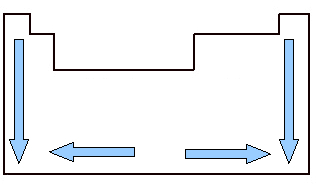
Atomų tūrio svyravimai periodinėje lentelėje šeimose ir laikotarpiuose
Jennifer Fogaça
Baigė chemiją
Šaltinis: Brazilijos mokykla - https://brasilescola.uol.com.br/quimica/volume-atomico.htm
