sp tipo anglies hibridizacija tai atsitinka tik tada, kai sukuria dvi pi jungtis (π) ir dvi sigmos obligacijas (σ). Tokiu atveju yra dvi galimybės: anglis gali sudaryti dvi dvigubas jungtis arba viengubą ir trigubą jungtį, kaip parodyta žemiau:
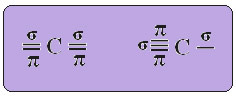
Tekstas "sp tipo hibridizacija3“Išsamiai parodo, kaip vyksta anglies hibridizacija. Prisimindami: hibridizacija yra grynų atominių orbitalių „maišymasis“, kurie sukuria hibridines atomines orbitales, kurios yra lygiavertės viena kitai, tačiau skiriasi nuo pradinių grynųjų orbitalių. Taigi, tai vyksta anglies orbitose, kurios iš pradžių buvo vaizduojamos taip:
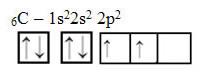
Tačiau gavus energiją, elektronas (kurį žymi rodyklė) iš 2s orbitos pakeliamas į 2p orbitą:
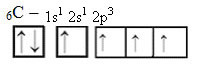
Tokiu būdu anglis turi keturias neporines orbitales, galinčias užmegzti keturias kovalentines jungtis, o ne tik dvi.
Sp tipo hibridizacijos atveju mes žinome, kad du ryšiai bus pi; tai vyksta grynose „p“ orbitalėse, o kitos dvi orbitalės, kurios yra sp hibridai, sukurs likusias sigmos jungtis.
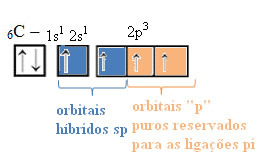
Šios hibridizacijos tarp s ir p orbitos erdvinis atvaizdavimas, dėl kurio atsiranda hibridinė sp orbita, gali būti pavaizduotas taip:
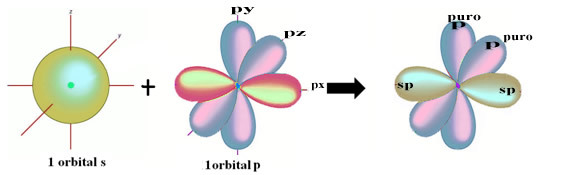
Aukščiau pateiktame paveikslėlyje labai aišku, kad yra dvi grynos orbitos, kurios sukurs pi ryšius.
Kad suprastumėte, kaip tai vyksta, paimkime vandenilio cianido (HCN) molekulę, naudojamą JAV dujų kamerose kaliniams, kuriems paskirta mirties bausmė. Jo struktūrinę formulę pateikia:
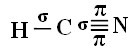
Kalbant apie anglį, jos atominės orbitos jau buvo parodytos, dabar pažvelkime į vandenilio ir azoto orbitales:
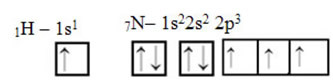
Atkreipkite dėmesį, kad neporinė vandenilio orbita, atliksianti sigmos ryšį, yra „s“, kurią erdvėje vaizduoja apskritimas; ir azoto orbitalės yra „p“ tipo, kurias vaizduoja trys dvigubi kiaušinėliai (kiekvienas erdviniame lauke: x, y, z). Taigi HCN molekulės struktūra pavaizduota taip:
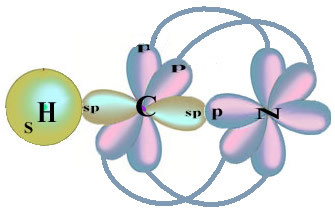
Kalbant apie šioje formaldehido struktūroje esančių obligacijų tipą, mes turime:
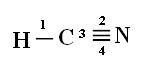
Jungtys: 1 = σs-sp
2 = σp-sp
3 = 4 = πp-p
Jennifer Fogaça
Baigė chemiją
Šaltinis: Brazilijos mokykla - https://brasilescola.uol.com.br/quimica/hibridizacao-tipo-sp.htm
