Cheminė kinetika yra sritis, tirianti veiksnius, turinčius įtakos cheminių reakcijų vystymosi greičiui, tai yra greičiui, kuriuo jos vyksta. Šioje srityje atliekama vis daugiau tyrimų, nes dažnai norime paspartinti kai kurias reakcijas arba sulėtinti kitas. Tai ypač svarbu pramonės šakoms ir šie tyrimai turi svarbių technologinių padarinių.
Bet kadangi reakcijos greitis gali skirtis kiekvienu laiko intervalu ir priklausomai nuo medžiagos, įprasta apskaičiuoti vidutinis reakcijos greitis.
Apsvarstykite šią bendrąją reakciją, kurioje koeficientai yra mažosios raidės, o reagentai ir produktai - didžiosiomis raidėmis:
a A + b B → c C + d D
Bus pateiktas vidutinis šios reakcijos greitis padalijant bet kurios iš reaguojančių medžiagų vidutinį reakcijos greitį arba vidutinį bet kurio iš produktų susidarymo greitį iš atitinkamo jo koeficiento cheminėje lygtyje. Tai suteikia:
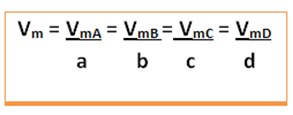
Pvz., Apsvarstykite vandenilio peroksido skilimo reakciją:
2 valandos2O2 (aq) → 2 H2O(1) + 1 O2 g)
Tarkime, kad per 1 minutę susidarė 0,3 mol / l H
2O ir 0,15 mol / l O2, o 0,3 mol / l H suyra2O2, tai yra, vidutiniai šių medžiagų skaidymo ir susidarymo greičiai reakcijos metu yra:VmH2O2 = 0,3 mol / l. min
VmH2O = 0,3 mol / l. min
VmO2 = 0,15 mol / l. min
Vidutinis visuotinės reakcijos greitis bus nustatytas imant vieną iš šių verčių ir padalijus ją iš atitinkamo koeficiento lygtyje:
Vm = VmH2O2 = 0,3 mol / l. min = 0,15 mol / l. min
2 2
Vm = VmH2O = 0,3 mol / l. min = 0,15 mol / l. min
2 2
Vm = VmO2 = 0,15 mol / l. min = 0,15 mol / l. min
1 1
Atkreipkite dėmesį, kad trys vertės yra vienodos, todėl reakcijos greitis yra toks pat kaip ir bet kurio reagento ar produkto funkcija tuo pačiu laiko tarpu.
Tačiau kaip buvo nustatytos kiekvienos medžiagos, dalyvaujančios šiose reakcijose, vidutinio greičio vertės?
Tai galima apskaičiuoti dalijant medžiagos (reagento ar produkto) koncentracijos kitimą iš laiko intervalo. Jei ketiname nustatyti vidutinį vieno iš greičių greitį reagentai reakcijos, turėsime įdėti a neigiamas ženklas prieš, arba apsvarstykite koncentracijos vertę modulyje ||, kadangi reagento koncentracija bėgant laikui mažėja, greičio vertė būtų neigiama, tačiau neigiamo greičio nėra.

Pavyzdžiui, apsvarstykite šią ozono dujų skilimo reakciją (O3 g)) deguonies dujose (O2 g)):
2 O3 g) → 3 O2 g)
Tarkime, kad balione buvo 10 molių ozono dujų, tačiau po 1 minutės liko tik 4 moliai; tai reiškia, kad 6 moliai ozono virto deguonies dujomis. Taigi mes turime:
2 O3 g) → 3 O2 g)
t = 0 min 2 mol / L 0 mol / L
susidarė išlaidos
6 mol / L 9 mol / L
t = 1 min 4 mol / L 9 mol / L
Atkreipkite dėmesį, kad kadangi reakcijos santykis yra 2: 3, tada, jei būtų naudojami 6 moliai O3Susidarė 9 mol O2. Taigi po 1 minutės mes turime tokį vidutinį greitį:
Vm = - ∆ [The3]
t
Vm = - ([O3finalas - O3 pradinis])
tGalutinis - tpradinis
Vm = - ([4 - 10])
1– 0
Vm = 6 mol / l. min→ 1 minutę kiekviename sistemos litre reagavo 6 mol ozono.
Vm = ∆ [The2]
t
Vm = ([O2finalas - O2 pradinis])
tGalutinis - tpradinis
Vm = ([9 - 0])
1– 0
Vm = 9 mol / l. min→ Per 1 minutę kiekviename sistemos litre susidarė 9 moliai deguonies.
Tai rodo, kad mes galime apskaičiuoti vidutinį greitį kaip reagentų arba produktų funkciją.
Dabar, jei norime apskaičiuoti vidutinį šios visuotinės reakcijos greitį, darykite taip, kaip parodėme pradžioje: padalykite kiekvieną iš šių greičių pagal atitinkamus jų koeficientus cheminėje lygtyje:
Vm = VmO3 = 6 mol / l. min = 3 mol / l. min
2 21
Vm = VmO2 = 9 mol / l. min = 3 mol / l. min
3 3
Vm = VmO3 = VmO2
23
Jennifer Fogaça
Baigė chemiją
Šaltinis: Brazilijos mokykla - https://brasilescola.uol.com.br/quimica/velocidade-das-reacoes-quimicas.htm

