tirpumas arba tirpumo koeficientas, tai fizinė materijos savybė, kuri visada praktiškai nustatoma laboratorijoje. Tai susiję su talpa, kurią vadina medžiaga ištirpęs, pristato, kad ištirptų kitas, tirpiklis.
Tirpumą tirpalai gali būti klasifikuojami taip:
Tirpumai: tie, kurie ištirpsta tirpiklyje. Pavyzdžiui, natrio chloridas (ištirpusios medžiagos) tirpsta vandenyje (tirpiklyje);
Šiek tiek tirpsta: tie, kuriems sunku ištirpti tirpiklyje. Tai yra kalcio hidroksido [Ca (OH) atvejis2] (ištirpusios medžiagos) vandenyje;
Netirpi: tie netirpsta tirpiklyje. Pavyzdžiui, smėlis (ištirpusios medžiagos) netirpsta vandenyje.
tirpumas yra labai susijęs su sprendimai (homogeniški mišiniai), nes norint gauti tirpalą, būtina, kad naudojamas ištirpęs tirpalas tirpiklyje.
Veiksniai, turintys įtakos tirpumui
Net kai ištirpusios medžiagos tirpus tirpiklyje, yra keletas veiksnių, galinčių turėti įtakos tirpiklio gebėjimui ištirpti. Ar jie:
a) Tirpiklio ir tirpiklio kiekio santykis
Tirpiklis visada turi ištirpusio tirpalo ribą. Jei padidiname tirpiklio kiekį išlaikydami ištirpusios medžiagos kiekį, tirpiklis linkęs ištirpinti visą naudojamą ištirpintą medžiagą.
B) Temperatūra
Temperatūra yra vienintelis fizinis veiksnys, galintis modifikuoti tirpiklio tirpumą tam tikros medžiagos atžvilgiu. Šis modifikavimas priklauso nuo tirpinio pobūdžio, kaip matysime toliau:
endoterminis tirpalas: yra ta, kurią mums pavyksta ištirpinti didesnę masę, jei tik tirpiklis yra aukštesnėje nei kambario temperatūra. Kuo karštesnis tirpiklis, tuo daugiau ištirpusios medžiagos ištirps.
Pavyzdys: Karštą vandenį galima ištirpinti didesnį kiekį maltos kavos.
Egzoterminis tirpalas: yra ta, kurią mums pavyksta ištirpinti didesnę masę, jei tik tirpiklis yra žemesnėje nei kambario temperatūra. Kuo šaltesnis tirpiklis, tuo daugiau ištirpusios medžiagos ištirps.
Pavyzdys: Kai soda yra šalta, galima ištirpinti didesnį anglies dioksido kiekį.
Tirpumo nustatymo būdai
Tirpumas yra eksperimentiniu būdu nustatoma savybė, todėl medžiagų tirpumas paprastai buvo įvertintas įvairiausiuose tirpikliuose. Taigi tirpalo tirpumą tam tikrame tirpiklyje galime pasiekti taip:
a) Lentelės analizė
Dažnai studentas gali susidurti su tirpumu aiškindamas lentelę. Žr. Šį pavyzdį:
Pavyzdys: (UEPG - pritaikytas) Žemiau esančioje lentelėje parodytas Li druskos tirpumas2CO3 100 gramų vandens.

Lentelėje pateikiamos Li masės vertės gramais2CO3 kurį galima ištirpinti 100 gramų vandens, nuo 0 OC iki 50 OÇ. Matome, kad kuo karštesnis vanduo, tuo mažiau Li2CO3 ištirpsta. Todėl Li2CO3 tai yra egzoterminis tirpalas (jis daugiau ištirps, jei vanduo bus šaltas).
b) Grafiko analizė
Tirpumą galima įvertinti interpretuojant grafiką. Norėdami tai padaryti, tiesiog nustatykite temperatūrą, pasukite ją į kreivę ir tada pasukite kreivę į y ašį, kuri yra ištirpusio tirpalo masė gramais.
Pavyzdys: (UFTM - pritaikytas) Grafike parodyta AX druskos tirpumo kreivė2.
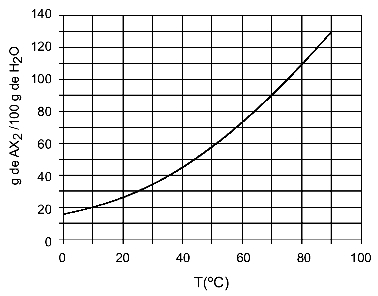
Grafike sakoma, kad y ašyje vandens (tirpiklio) kiekis yra 100 gramų. Tirpiam AX2, vandens kiekį nustatysime šiose temperatūrose:
30OÇ: Kai įjungsime 30 temperatūrąOC iki kreivės ir tada kreivė iki y ašies, turime tokią temperatūrą, kad 100 gramų vandens gali ištirpinti maždaug 35 gramus ištirpusios medžiagos AX2.
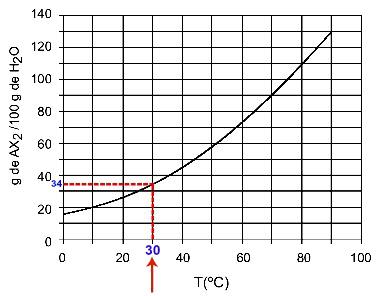
AX tirpumo nustatymas2 30 mOÇ
40OÇ: Kai įjungsime 40 temperatūrąOC iki kreivės ir tada kreivė iki y ašies, turime tokią temperatūrą, kad 100 gramų vandens gali ištirpinti maždaug 45 gramus ištirpusios medžiagos AX2.
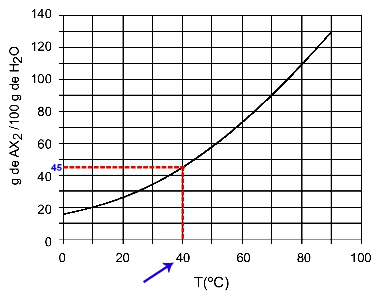
AX tirpumo nustatymas2 40 mOÇ
Kadangi ištirpusio ištirpusio tirpalo kiekis didėja kiekvieną kartą padidėjus temperatūrai, turime tą AX2 tai yra endoterminis tirpalas.
c) tekstinis aiškinimas
Žr. Šį pavyzdį:
Pavyzdys: (PUC-MG) Tam tikros medžiagos gali sudaryti homogeninius mišinius su kitomis medžiagomis. Medžiaga, kurios yra didžiausias kiekis, vadinama tirpikliu, o mažiausia - tirpia medžiaga. Natrio chloridas (NaCl) su vandeniu sudaro homogenišką tirpalą, kuriame 20 ° C temperatūroje galima ištirpinti 36 g NaCl 100 g vandens.
Tekste teigiama, kad jei turime 100 gramų vandens (tirpiklio), esant 20 ° C temperatūrai OC, galima ištirpinti iki 36 gramų NaCl.
Mano. Diogo Lopes Dias
Šaltinis: Brazilijos mokykla - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-solubilidade.htm


