cheminis elementas fosforas (P) priklauso trečiajam periodinės lentelės periodui ir azoto (VA) šeimai. Dėl šios priežasties jo atomai paprastai sudaro tris cheminiai ryšiai pasiekti okteto teorija (stabilumas). Tačiau yra keletas situacijų, kai fosforo atomas užmezga daugiau nei tris jungtis, o tai įmanoma tik per hibridizacijos reiškinys.
Norėdami suprasti fosforo hibridizacija, pirmiausia turime suprasti, kodėl šio elemento atomas užmezga tris jungtis. Norėdami tai padaryti, mes tiesiog turime stebėti jūsų elektroninį platinimą:

Elektroninis fosforo paskirstymas
Galime pastebėti, kad valentiniame sluoksnyje fosforo atomas turi visą 3s pakopą (su du elektronai) ir nepilną 3p pakopą (kiekviena iš trijų p pakopinių orbitalių turi a elektronas). Žemiau mes turime elektronų pasiskirstymą sublygių orbitose Fosforo valentinis sluoksnis:
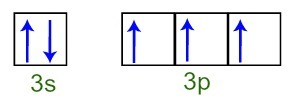
Fosforo atomo valentinio apvalkalo elektronų atvaizdavimas
Kadangi kiekviena iš 3p pakopinių orbitalių yra neišsami, fosforo atomas sugeba užmegzti tris chemines jungtis, taip pasiekdamas stabilumą.
Dabar, kai pažvelgsime į medžiagą PCl5, pavyzdžiui, esame tikri, kad šioje molekulėje fosforas buvo hibridizuotas, nes jis užmezgė penkis ryšius. Kadangi chloras, priklausantis VIIA šeimai, turi ryšį, kad jis būtų stabilus, ir molekulėje yra penki šio atomai elementas, kiekvienas iš jų turi užmegzti ryšį, dėl kurio fosforo atomas savo ruožtu taip pat turi sukurti penkis Jungtys. Šis įvykis įmanomas tik per fosforo hibridizacija (nepilnų atominių orbitalių susijungimas).
Gaunant energiją iš išorinės aplinkos, fosforo atomo elektronai jaudinasi. Netrukus po to vienas iš dviejų elektronų, priklausančių 3s pakopai, pereina į tuščią orbitalę, esančią d pakopoje, kurioje iki tol nėra jokių elektronų. Žr. Toliau pateiktą diagramą:
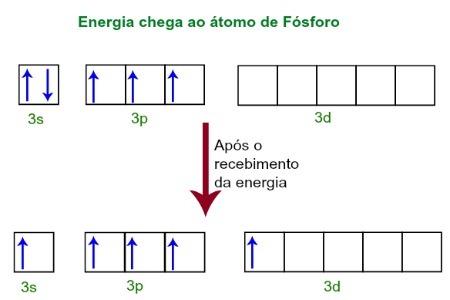
Gaunant energiją, fosforo elektronai yra sužadinami ir vienas užima d pakopos orbitą.
Šiuo metu fosforo valentiniame sluoksnyje yra s orbita, trys p orbitalės ir nepilna d orbita.Galų gale šios penkios orbitalės hibridizuojasi, tai yra, susijungia, todėl susidaro penkios nepilnos atominės orbitalės, kurios dabar gali užmegzti penkias chemines jungtis.

Nepilnų fosforo atominių orbitalių hibridizacija
Sujungus tris orbitales, tris orbitales ir d orbitalę, fosforo hibridizacija yra tokio tipo sp3d.
Mano. Diogo Lopes Dias
Šaltinis: Brazilijos mokykla - https://brasilescola.uol.com.br/quimica/hibridizacao-fosforo.htm

