Kai gaminame maistą savo namuose, naudojame degimo dujas. Vienas iš dalykų, kurį galime pamatyti degant šioms dujoms liepsnoje, yra tai, kad jų spalva paprastai yra labai šviesiai mėlyna. Tačiau daugumoje degimo reakcijų, pavyzdžiui, deginant žvakę, liepsna yra geltona.

Tada kyla klausimas:
"Jei kiekvienas gaisras yra degimo reakcijos rezultatas, kodėl kai kurios liepsnos turi skirtingas spalvas?"
Norėdami suprasti, kaip tai vyksta, turime suprasti, kas yra degimo reakcija ir kokios medžiagos yra kiekvienoje iš minėtų reakcijų.
Degimo reakcija įvyksta, kai oksidatorius (dujinė medžiaga, kuriame yra deguonies) sunaudoja kurą (oksiduojamą medžiagą) šilumai energijai (šilumai) generuoti.
Kitas svarbus dalykas, kurį turime žinoti apie degimo reakcijas, yra tai, kad jie gali vykti a išsami arba neišsami. Jei deguonies pakanka degalams sunaudoti, reakcija bus baigta ir susidarys anglies dioksidas (CO2) ir vandens (H2O). Priešingu atveju degimas bus dalinis, neišsamus, susidarys anglies monoksidas (CO) ir vanduo; arba anglies (C) ir vandens.
Abiem atvejais mes analizuojame, kad oksidatorius yra ore esantis deguonis. Tačiau kuras skiriasi. Virimo dujos iš tikrųjų yra suskystintos naftos dujos (SND), kurios yra angliavandenilių (alkanų) mišinys, pagrindinis kuras yra butanas (C4H10). Taigi virimo dujos susideda iš alkano molekulių, kurios turi tik trys ar keturi anglies atomai, todėl jo degimui visiškai vykti reikia mažai deguonies. Ši reakcija gali būti išreikšta taip:
1C4H10 g) + 13/2 O2 g) → 4 CO2 g) + 5 valandos2Og), ∆H <0
Žvakių atveju parafinas yra reakcijos kuras ir jis susideda iš alkanų mišinio su anglies atomais, kurie svyruoja nuo 20 iki 36. Taigi, norint, kad ši reakcija vyktų visiškai, reikia daug daugiau deguonies. Žr. Pavyzdį:
1C24H50 (s) + 70/2 O2 g) → 25 CO2 g) + 25 H2Og), ∆H <0
Ore nėra pakankamai deguonies šiam visiškam degimui atlikti, todėl jis vyksta nepilnai, kaip parodyta žemiau:
1C24H50 (s) +49/2 O2 g) → 24 COg) + 25 H2Og), ∆H <0
1C24H50 (s) +25/2 O2 g) → 24Cs + 25 H2Og), ∆H <0
Neužbaigtos reakcijos sukuria mažiau energijos nei visiškas degimas. Tai paaiškina liepsnos spalvų skirtumą, nes geltona liepsna, būdinga nepilnam degimui, turi mažesnę energiją. Mėlyna liepsna būdinga visiškam degimui su didesne energija.
Tai taip pat paaiškina suodžių susidarymą žvakės liepsna (nuotrauka pateikiama žemiau), kuri yra anglis, laikoma nevisiško degimo produktu.
Bet kodėl „Bunsen“ degiklyje įmanoma gauti geltonos ir mėlynos spalvos liepsnas, kai kuras nesikeičia?
„Bunsen“ degiklio atveju tai pasiekiama reguliuojant dujų ir oro įleidimą. Jei langas bus uždarytas, todėl pateks į nedidelį kiekį oro, gaunama liepsna bus geltona, nes ji turės mažai deguonies, kad galėtų visiškai degti. Jei dujų ir oro mišinio reguliavimas yra pakankamas, gauname mėlyną liepsną.
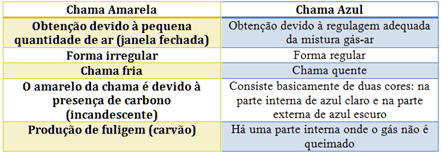
Žiūrėkite kiekvieno iš jų charakteristikas toliau pateiktoje lentelėje:
Jennifer Fogaça
Baigė chemiją
Šaltinis: Brazilijos mokykla - https://brasilescola.uol.com.br/quimica/combustao-chamas-cores-diferentes.htm


