THE baterija yra sistema, kurioje vyksta oksidacijos-redukcijos reakcija. Šiame įrenginyje spontaniškos reakcijos metu susidariusi cheminė energija paverčiama elektros energija.
Oksidacijos ir redukcijos reakcijos ląstelėje vyksta vienu metu. Kai viena rūšis oksiduojasi, ji atiduoda elektronus kitai rūšiai, kuri, juos gavusi, redukuojasi.
Todėl tas, kuris oksiduojasi, yra reduktorius, o tas, kuris redukuojamas, yra oksidatorius.
THE oksidacija įvyksta, kai rūšis praranda elektronus ir tampa katijonu: A → A+ + ir-.
THE sumažinimas įvyksta, kai rūšis įgyja elektronų ir tampa elektriškai neutrali: B+ + ir- → B.
Cheminėse lygtyse tai elektronų pernešimas parodomas oksidacijos skaičiaus (nox) pokyčiu.
Ląstelių viduje vyksta redukcijos reakcijos, o elektros srovė atsiranda elektronams migruojant iš neigiamo į teigiamą polių.

Kaip veikia kaminas?
Vienas redokso reakcija paprastai gali būti pavaizduotas lygtimi:
A + B+ → A+ + B
kur,
A: medžiaga, kuri oksiduojasi, praranda elektronus, padidina savo vertę ir yra reduktorius.
B: medžiaga, kuri redukuojasi, įgyja elektronų, mažina oksidaciją ir yra oksidatorius.
Žiūrėkite toliau pateiktame paveikslėlyje, kaip galima pavaizduoti šį procesą.
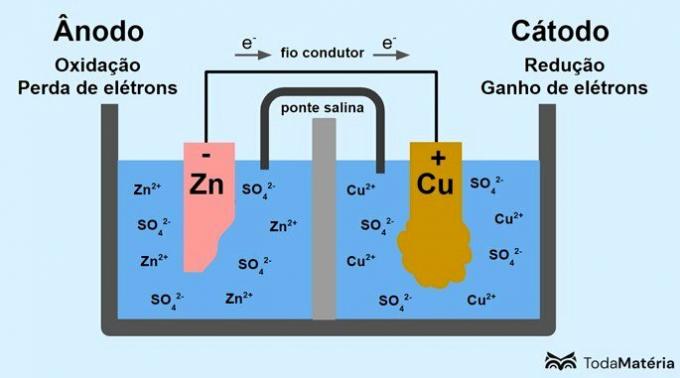
Sistemą, padalytą į dvi pusląsteles ir sudarytą iš dviejų metalinių elektrodų, išoriškai sujungtų laidžia viela, sukūrė John Frederic Daniell (1790–1845) 1836 m.
Baterija susideda iš dviejų elektrodų, sujungtų laidžia viela, ir elektrolito, kuriame yra jonai. Elektrodas yra kietas laidus paviršius, leidžiantis keistis elektronais.
anodas: elektrodas, prie kurio vyksta oksidacija. Tai taip pat yra neigiamas akumuliatoriaus polius.
Katodas: elektrodas, prie kurio vyksta redukcija. Tai taip pat yra teigiamas akumuliatoriaus polius.
Aukščiau esančiame paveikslėlyje metalinis cinkas yra anodas ir yra apdorojamas oksidacija. Metalinis varis yra katodas ir redukuojamas. Elektronų migracija (e-) vyksta iš anodo į katodą per laidžią laidą.
Vaizdo sistemoje vykstančios reakcijos yra šios:
- anodas (oksidacija): Zn(s) → Zn2(čia) + 2e-
- Katodas (sumažinimas): Cu2+(čia) + 2e- → asilas(s)
- bendroji lygtis: Zn(s) + asilas2+(čia) → asilas(s) + Zn2+(čia)
Cinkas yra metalas, turintis didesnę tendenciją prarasti elektronus, todėl tirpale susidaro katijonai. Cinko elektrodas pradeda nusidėvėti ir prarasti masę, nes cinkas išsiskiria į tirpalą, kai susidaro cinko katijonai.2+.
Iš anodo elektronai patenka į katodą, o metalo katijonai, juos gavę, virsta metaliniu variu, kuris nusėda ant elektrodo ir padidina jo masę.
Druskos tiltelis yra joninė srovė, atsakinga už jonų cirkuliaciją sistemoje, kad ji būtų elektriškai neutrali.
Taip pat skaitykite apie oksidacijos skaičius (nox).
baterijų tipai
Ląstelėje cheminių rūšių polinkį priimti arba atiduoti elektronus lemia redukcijos potencialas.
Komponentas, turintis didžiausią redukcijos potencialą, yra linkęs redukuotis, ty gauti elektronų. Rūšys, turinčios mažiausią redukcijos potencialą ir, atitinkamai, didžiausią oksidacijos potencialą, yra linkusios perkelti elektronus.
Pavyzdžiui, redokso reakcijoje Zn0(s) + asilas2+(čia) → asilas0(s) + Zn2+(čia)
Cinkas oksiduojasi ir atiduoda elektronus, nes turi redukcijos potencialą E0 = -0,76 V, mažesnis nei vario E redukcijos potencialas0 = +0,34 V, todėl jis priima elektronus ir redukuojasi.
Žemiau rasite kitų krūvų pavyzdžių.
Cinko ir vandenilio kaminas
Oksidacijos pusinė reakcija: Zn(s) → Zn2+ + 2e- (IR0 = -0,76 V)
Redukcijos pusinė reakcija: 2H+(čia) + 2e- → H2(g) (IR0 =0,00 V)
Pasaulinė lygtis: Zn(s) + 2H+(čia) → Zn2+(čia) + H2(g)
Stacko vaizdavimas:
Vario ir vandenilio elementas
Pusinė oksidacijos reakcija: H2(g) → 2H+(čia) + 2e- (IR0 = 0,00 V)
Redukcijos pusinė reakcija: Cu2+(čia) + 2e- → asilas(s) (IR0 = +0,34 V)
Pasaulinė lygtis: Cu2+(čia) + H2(g) → 2H+(čia) + asilas(s)
Stacko vaizdavimas:
Gaukite daugiau žinių šia tema naudodami turinį:
- elektrochemija
- Elektrolizė
Bibliografinės nuorodos
FONSECA, M. R. M. Chemija, 2. 1. red. San Paulas: Atika, 2013 m.
SANTOS, W.L.P; MOL, G.S. Piliečių chemija, 3. 2. red. San Paulas: AJS redaktorius, 2013 m.
USBERCO, J. Jungtis chemija, 2: chemija. - 2. red. San Paulas: Saraiva, 2014 m.