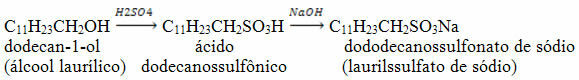Su šia klase mokinys galės
1. Atsekti chronologinę materijos sandaros tyrimo istorinės-mokslinės raidos liniją nuo graikų filosofų sukurtos atomo sampratos iki dabartinio atomo modelio.
2. Atskirkite sukurtus atominius modelius, susijusias teorijas ir atomo sandaros vaizdavimo raidą.
3. Gebėti atpažinti ir atskirti daleles, iš kurių susidaro atomas.
1. Diskusija apie dalyko sudėtį
Skirtingų medžiagų pristatymas mokiniams ir diskusijų apie tai, iš ko jos pagamintos, sukėlimas, gilinimasis į charakteristikas, kol pasiekiamas bendras jų visų komponentas – atomas.
2. Teorinis temos pristatymas
Pristatykite medžiagų sudėties teorijų raidą, atomo sampratą ir mokslininkų indėlį kuriant atomus vaizduojančius modelius.
Pabrėžkite atominių modelių skirtumus ir pabrėžkite, kad informacija apie atomą buvo atrasta ir paskatino sukurti naujus modelius.
3. Įvertinimas
Leiskite mokiniui pritaikyti tai, ko išmoko, naudodami pratimų sąrašą.
1. Cheminių elementų klasifikacijos raida
Pateikite modelius, naudojamus klasifikuojant cheminius elementus, kurie buvo jų kūrėjai, kokie elementai buvo žinomi iki tol ir kokią informaciją naudojo prieš pasiekdami standartą srovė.
2. Cheminių elementų pristatymas
Parodykite mokiniams cheminius elementus, kaip jie pavaizduoti lentelėje ir kur jų galima rasti kasdieniame gyvenime. Pabrėžkite kai kurių elementų, tokių kaip fosforas, pirmasis aptiktas elementas, vandenilis, atradimą, gausiausias elementas visatoje ir gyvsidabris, vienintelis kambario temperatūroje skystos būsenos metalas.
3. Atominis skaičius ir atomo sandara
Peržiūrėkite atomo struktūrą ir nustatykite, kur yra protonai. Paaiškinkite, kodėl periodinė lentelė yra išdėstyta didėjančio atominio skaičiaus, ty protonų skaičiaus, tvarka.
4. Periodinės lentelės pristatymas
Pabrėžkite, kad 118 žinomų cheminių elementų yra paskirstyti 18 periodinės lentelės grupių ir 7 periodų, ir šio įrankio svarbą. Apibrėžkite, kas yra grupės ir laikotarpiai, pateikdami pagrindines charakteristikas.
Su šia klase mokinys galės
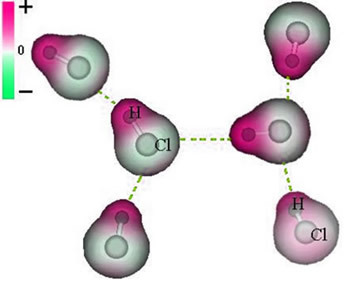
1. Nurodykite cheminių ryšių sampratą ir pagrindinius tipus (joninius, kovalentinius ir metalinius).
2. Paaiškinkite, kodėl atomai jungiasi ir kaip susidaro cheminės medžiagos.
3. Apibrėžkite okteto taisyklę, paaiškinkite, kas yra atomų valentingumas ir jo svarba cheminių ryšių tyrimui.
4. Atpažinti, apibūdinti ir apibūdinti cheminių jungčių modelius, kaip jie atsiranda ir kokius junginius jie sudaro.
1. Kaip susidaro cheminės medžiagos?
Naudokite praktinius, kasdienius pavyzdžius, kad paskatintumėte idėjų apie medžiagų sudėtį plėtrą klasėje. Kaip pavyzdį galite naudoti valgomąją druską ir cukrų, kad parodytumėte skirtumus tarp junginių savybes ir struktūras, kurias studentai gali apmąstyti, kol pasieks surišimo sampratą chemija.
2. okteto teorija
Supažindinkite mokinius su Lewis struktūra ir elektroniniu pasiskirstymu, kad būtų galima pavaizduoti atomus ir palengvinti valentinio apvalkalo ir valentinių elektronų vizualizavimą. Pristatykite oktetų teorijos sąvoką ir naudokite inertinių dujų grupę kaip pavyzdį palyginimui jo stabilumas ir charakteristikos su kitų grupių elementais, tokiais kaip šarminiai metalai ir halogenai.
3. Cheminių jungčių rūšys
Apibrėžkite kiekvieną cheminių jungčių tipą ir pabrėžkite, kaip jie atsiranda, kam jie skirti ir cheminių jungčių tipus. Toliau naudokitės praktiniais pavyzdžiais, kad mokiniai galėtų susieti išmoktas sąvokas su kasdienėmis problemomis.
Užsiėmimo tikslas – pateikti cheminių ryšių apžvalgą. Vėliau reikėtų mokyti konkrečias kiekvieno tipo pamokas, kad būtų galima giliau įsigilinti į temą.
4. Periodinė lentelė ir cheminių jungčių tyrimas
Supažindinkite su periodinėmis elektronegatyvumo ir elektropozityvumo savybėmis ir kaip jos svarbios kuriant cheminius ryšius. Periodinėje lentelėje parodykite, kur yra elementai, turintys didžiausią polinkį atiduoti ir priimti elektronus.
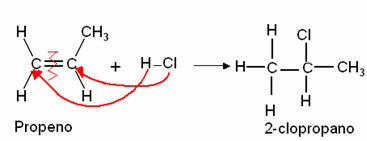
1. Kas yra cheminė reakcija?
Mokytojas gali panaudoti kasdienį cheminį reiškinį, iliustruodamas cheminę reakciją, pvz., nagų rūdijimą, medienos deginimą ar piliulės putojimą ir stimuliavimą. mokinių dalyvavimas skaičiuojant poveikį, kuris akivaizdžiai rodo reakcijos atsiradimą, pvz., spalvos pasikeitimą, temperatūros pokytį, kietų medžiagų susidarymą ir išsiskyrimą dujų. Po to surinkite informaciją ir kartu pasiekite cheminės transformacijos apibrėžimą.
2. Skirtumas tarp cheminės transformacijos ir fizinės transformacijos
Pristatykite įvairius reiškinius ir paprašykite mokinių priskirti juos prie fizinių ir cheminių pokyčių. Sutelkite dėmesį į medžiagų sudėties stebėjimą prieš ir po transformacijos ir pabrėžkite pokyčio tipą struktūroje, kad būtų galima atskirti fizikinius ir cheminius reiškinius, susijusius su naujų formų susidarymu ar ne medžiagų.
3. Cheminių reakcijų vaizdavimas
Naudokite periodinę lentelę, kad paaiškintumėte, kaip apibūdinti cheminius junginius ir, atitinkamai, cheminius elementus, dalyvaujančius reakcijoje.
Pradėkite nuo bendrų vaizdų, kad pataisytumėte apibrėžimą ir pateiktumėte cheminės lygties narius. Pavyzdžiui, sudėjimo reakcijai A ir B yra reagentai, o AB yra produktas:
A + B → AB
Tada pristatykite chemines reakcijas, kurios iš tikrųjų vyksta. Tokio tipo reakcijai susidaro geležies II sulfidas.
Fe + S → FeS
Taip pat reikėtų pabrėžti cheminių lygčių balansavimo svarbą ir tai, kad reagentuose esančių atomų skaičius turi būti lygus produkte esančių atomų skaičiui. Taip pat apibūdinkite sudedamųjų dalių fizinę būseną: kietas (s), skystis (l) ir dujinis (g).
4. Cheminių reakcijų dėsniai
Svarstomi dėsniai yra dėsniai, reguliuojantys chemines reakcijas ir pateikiantys gaires dėl transformacijų kiekybinių aspektų. Todėl studentas turi mokėti fiksuoti šių dėsnių teiginius ir pritaikyti juos rašydamas chemines reakcijas.
5. Cheminių reakcijų rūšys
Vaizdo įrašuose pristatykite įvairius cheminių reakcijų tipus, pavyzdžiui, su transformacijomis kasdieniame gyvenime, kad būtų lengviau suvokti cheminių junginių struktūrą.
Taip pat pateikite reakcijų sąlygas ir kur jas pavaizduoti cheminėje lygtyje, pvz., šviesa, šiluma, katalizatorius ir kt.
1. Pateikite skirtingas medžiagas ir cheminę formulę, kuri atspindi kiekvienos iš jų sudėtį. Pateikdami cheminių elementų atomus parodykite, kokios medžiagos gali būti susidaro iš vienos rūšies elementų (paprastų medžiagų) arba iš daugiau nei vieno cheminio elemento (medžiagų). kompozitai).
2. Prisiminkite cheminių ryšių sąvokas ir paaiškinkite, kaip atomai jungiasi, sudarydami joninius junginius (joninis ryšys) ir molekules (kovalentinius ryšius).
3. Atminkite, kad be grynų medžiagų gali susidaryti ir mums žinomos medžiagos mišinius (vienarūšius ar nevienalyčius) ir pateikite pavyzdžių, kad mokiniai galėtų atskirti.