O aliuminio yra cheminis elementas, kurio atominis numeris 13, ir yra periodinės lentelės 13 grupės (IIIa šeimos) dalis. Tai labiausiai paplitęs metalas žemės plutoje ir trečias pagal paplitimą elementas pasaulyje po deguonies ir silicio.
Pagrindinės jo charakteristikos: lengvas metalas, minkštas, lengvai formuojamas, sidabriškai baltos spalvos, laidus elektrai ir atsparus korozijai.
Dar viena svarbi savybė – aliuminis yra lengvai perdirbamas, todėl metalo perdirbimo procesas yra plačiai naudojamas ir daug pigesnis nei jo išgavimas.
Gamtoje jis randamas sudarantis junginius su kitais elementais rūdose, tai yra, jis nėra grynas ir sudaro 8% žemės paviršiaus svorio.
Įvairių kasdienių daiktų sudėtyje yra aliuminio. Žinomiausios šio metalo panaudojimo galimybės: aliuminio folija, gėrimų skardinės, keptuvės ir antiperspirantai. Dėl mažo tankio jis plačiai naudojamas aviacijos ir kosmoso pramonėje gaminant orlaivių fiuzeliažą.
aliuminio savybės
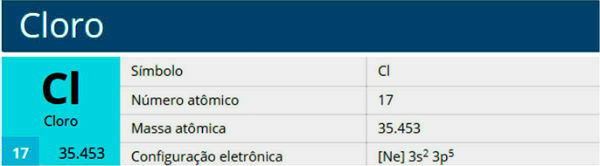
- Simbolis: Al
- Atominis skaičius: 13
- Atominė masė: 26,982
- Lydymosi temperatūra 660,32°C
- Virimo temperatūra 2519°C
- Tankis: 2,70 g/cm3
- Fizikinė būsena esant 20°C: Kieta
- Elektroninis platinimas: [Ne] 3s23p1
- Izotopų skaičius: 22, o Al-27 yra stabiliausias
Aliuminis grynas yra gana reaktyvus, silpnas ir minkštas. Todėl jis parduodamas su nedideliu kiekiu kitų atsparesnių elementų, tokių kaip geležis ir silicis.
Aliuminis turi amfoterinį pobūdį, tai yra, priklausomai nuo terpės, jis veikia kaip rūgštis arba bazė. Pavyzdžiui, aliuminio oksido sąlytis su kalio hidroksidu (KOH), stipria baze arba kartu su vandenilio chlorido rūgštis (HCl), stipri rūgštis, įvyks neutralizacijos reakcija, dėl kurios susidarys druska ir Vanduo.
Al2O3(s) + 6 HCl (vandens) → 2 AlCl3(vandens) + 3H2(l)
Al2O3(s) + 2KOH(aq) → 2 KAlO2(aq) + H2(l)
Koncentruotos rūgštys ir bazės gali atakuoti medžiagas su aliuminiu ir greitai jas ištirpinti.
aliuminio charakteristikos
Aliuminis yra lengvas metalas, maždaug tris kartus lengvesnis už geležį, lengvai apdirbamas ir formuojamas. Tai taip pat puikus elektros ir šilumos laidininkas.
Tai patvari ir atspari korozijai medžiaga, nes aliuminis lengvai reaguoja su deguonimi kontaktuojant su oru, po metalu susidaro aliuminio oksido sluoksnis, kuris atlieka plėvelės funkciją apsauginis.
Didelis jo reaktyvumas yra viena iš priežasčių, kodėl gryno aliuminio gamtoje nėra. Dėl mažo toksiškumo šio metalo junginiai naudojami, pavyzdžiui, kosmetikoje ir vandens valymui.
Siekiant pagerinti jo savybes, kiti elementai, tokie kaip varis, cinkas ir silicis, sujungiami su aliuminiu, kad susidarytų metalų lydiniai.
Kur randamas aliuminis?
Lauko špato tipo uolienos, kurios sudaro 60% žemės plutos, turi aliuminio.
Pagrindinis aliuminio šaltinis komerciniam naudojimui yra boksito rūda, kurios pagrindinė sudedamoji dalis yra aliuminio oksidas (Al2O3).
Brangakmeniai, tokie kaip rubinas ir safyras, yra to paties mineralo, korundo, kuris yra aliuminio oksidas (Al) atmainos.2O3) ir jo spalva skiriasi priklausomai nuo esamų priemaišų: rubino raudona atsiranda dėl chromo, o safyro mėlyna – dėl geležies arba titano.
Gaukite daugiau žinių apie turinį:
- Cheminiai elementai
- metalo lydiniai
- Kas yra metalai, pavyzdžiai ir savybės
Bibliografinės nuorodos
ATKINS, P.W.; JONES, Loreta. Chemijos principai: šiuolaikinio gyvenimo ir aplinkos suabejojimas. 3.red. Porto Alegrė: „Bookman“, 2006 m.
FELTRE, Ricardo. Chemijos pagrindai: t. viengungis. 4-asis leidimas San Paulas: Moderna, 2005 m.
Lee, J. D. Ne tokia glausta neorganinė chemija. 5-ojo leidimo vertimas. Anglų. Leidėjas Edgard Blucher Ltd. 1999.