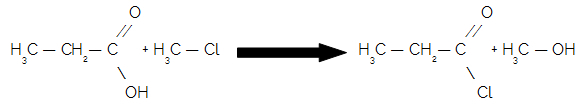
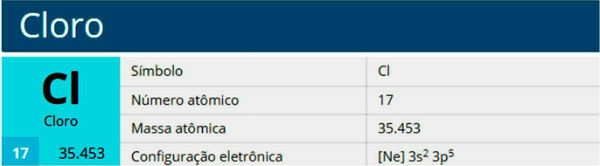
Chloras yra cheminis elementas, kurio simbolis Cl, atominis skaičius 17, atominė masė 35,5. Jis priklauso halogenų šeimai, 17 arba 7A grupei, ir trečiajam periodinės lentelės periodui.
Jo pavadinimas kilo iš graikų kalbos khloros, kuris reiškia žalsvą. Taip yra todėl, kad normaliomis temperatūros ir slėgio sąlygomis chloras apibūdinamas kaip žalsvai geltonos dujos, turinčios stiprų kvapą.
funkcijos
Chlorą 1774 m. Atrado švedų mokslininkas Carlas Wilhelmas Scheele'as (1742–1786). Tačiau tuo metu tikėjau, kad tai junginys su deguonimi. 1810 m. Humphry Davy (1778–1829) parodė, kad tai yra naujas cheminis elementas.
Kadangi tai yra nepaprastai reaktyvus elementas, grynai gamtoje jo beveik nėra, išskyrus nedidelį kiekį, išsiskiriantį per ugnikalnio išsiveržimus HCl pavidalu.
Taigi jis dažniausiai randamas natrio chlorido (NaCl) pavidalu, taip pat žinomu kaip valgomoji druska. Mineraluose jis pasireiškia karnalito ir Silvito pavidalu.
Jį taip pat galima gauti elektrolizė NaCl vandeniniame tirpale. Chloras taip pat gamina daug druskų iš chloridų oksidacija.
Sužinokite daugiau, taip pat skaitykite:
- Periodinė elementų lentelė
- Cheminiai elementai
- Halogenai
programos
Chloro dujos (Cl2) yra toksiška ir dirginanti, dėl šios būklės 1-ojo pasaulinio karo metu jis buvo naudojamas kaip cheminis ginklas. Šios dujos sukelia dirginimą kvėpavimo takuose ir odoje, vandens sulaikymą plaučiuose, ašarojimą ir įkvėpus didelius kiekius, gali sukelti mirtį.
Kai kurie kiti chloro naudojimo būdai yra šie:
- Popieriaus ir audinių balinimas naudojant chloro dioksidą (ClO2).
- Vandens valymas, chloro pridėjimas daro vandenį geriamą ir tinka vartoti žmonėms. Šis procesas vadinamas chlorinimu ir naudoja hipochloro rūgštį (HClO).
- Dezinfekuoti baseino vandenį ir pramonines atliekas, nes chloras gali sunaikinti mikroorganizmus.
- Plastikinių junginių, tokių kaip PVC (polivinilchloridas) ir sintetinio kaučiuko, gamyba.
- Kai kurių rūšių organinių ir neorganinių junginių gamyba.