Kuo aukštesnė temperatūra, tuo didesnis reakcijos greitis.
Tai galima lengvai pastebėti daugelyje kasdienio gyvenimo situacijų, pavyzdžiui, iš šių pavyzdžių:
- Kai norime sulėtinti maisto skilimo reakciją, žeminame temperatūrą, padėdami jį į šaldytuvą;

- Jei norime paspartinti maisto gaminimo reakciją, tiesiog įdėkite jį į virimo puodą. slėgis, kuris, didėjant slėgiui, taip pat padidina skysto vandens, kuriame maistas yra;

- Gaisrai, paprastai, yra pražūtingi, nes padidėja aplinkos temperatūra, dėl kurios padidėja degimo reakcijos greitis;
- Norėdami sulėtinti medžiagų apykaitos cheminius procesus, sumažindami smegenų pažeidimo tikimybę dėl deguonies trūkumas, kai kurios operacijos atliekamos sumažinant paciento kūno temperatūrą, pasiekiant aplink 15 ° C;
- Jei putojančią tabletę įdėsime į stiklinę karšto vandens, o kitą - į stiklinę šalto, pirmoji ištirps daug greičiau.
Bet kas paaiškina tiesiogiai proporcingą temperatūros įtaką reakcijos greičiui?
Taip yra todėl, kad, kaip paaiškinta tekste „Cheminių reakcijų atsiradimo sąlygos
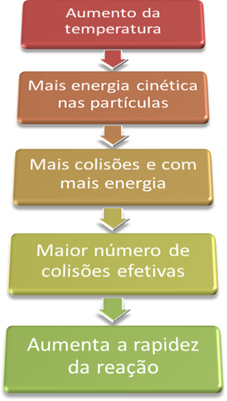
“, Kad reakcija vyktų, būtina įvykdyti kai kurias sąlygas, pavyzdžiui, kad dalelės jie turi susidurti efektyviai ir su minimalia reikalinga energija, kuri vadinama aktyvacijos energija.Taigi, padidinę sistemos temperatūrą, padidiname ir reaguojančių dalelių maišymą ir suteikiame joms daugiau kinetinės energijos. Tai padarys daugiau susidūrimų ir su daugiau energijos, padidins reaguojančių dalelių kiekį ir, atitinkamai, padidins reakcijos greitį.
Jennifer Fogaça
Baigė chemiją
Šaltinis: Brazilijos mokykla - https://brasilescola.uol.com.br/quimica/temperatura-velocidade-das-reacoes.htm
