Mechanizmas yra reakcijos apdorojimo būdo modeliavimas, jis apibūdina veiksmus, kuriuos reagentai atlieka, kad pasiektų galutinį produktą.
Mechanizmai buvo pasiūlyti remiantis eksperimentais, nes neįmanoma įsivaizduoti reakcijos žingsnio ir yra labai naudingi Organinė chemija, nes organiniai junginiai reaguoja tarpusavyje įvairiais būdais: nutraukia ryšius, formuojasi junginiai tarpininkai.
Yra veiksnių, kurie trukdo galutiniam reakcijos produktui, pavyzdžiui, tirpiklio pobūdis, ryšių poliškumas, elektronų mainai ir kt. Todėl ne visada tam tikras mechanizmas yra vienintelis produkto susidarymo būdas, jie gali atsirasti įvairiais būdais, pavyzdžiui, joniškai arba per laisvuosius radikalus.
1. joninis mechanizmas: procesas, kuris prasideda heterolitiniu kovalentinio ryšio plyšimu ir jonų (karbokationo ir karbaniono) susidarymu.
Stebėkite alkeno halogeninimo mechanizmą.
Mechanizmą galime suskirstyti į etapus:
1-asis etapas: Heterolitinis kovalentinio ryšio (Cl-Cl) suardymas: karbokationo ir anijono (Cl-) susidarymas.
2-asis etapas: Chlorido anijonų (Cl-) ataka karbokacijai.
3 etapas: Produkto 1,2 susidarymas - dichlorpropanas.
Kaip matyti, alkenų halogeninimas vyksta per joninį mechanizmą.
Pastaba: Kaip rodo pavadinimas, halogeninimas atliekamas į molekulę pridedant halogeno (chloro).
2. Mechanizmas per laisvuosius radikalus: homolizinis kovalentinio ryšio plyšimas sudaro laisvuosius radikalus (labai nestabilius ir reaktyvius), pažiūrėkime į pavyzdį:
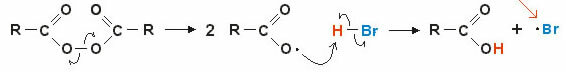
Reakcija prasideda peroksidinės jungties nutrūkimu ir laisvųjų radikalų susidarymu. Tarpiniame etape radikalas atakuoja poliarizuotą vandenilį (H – Br) ir dėl to susidaro naujas laisvasis radikalas. br (labai nestabilus ir reaktyvus).
Líria Alves
Baigė chemiją
Brazilijos mokyklos komanda
Žiūrėti daugiau!
Radikalai organinėje chemijoje
Organinė chemija - Chemija - Brazilijos mokykla
Šaltinis: Brazilijos mokykla - https://brasilescola.uol.com.br/quimica/mecanismos-reacoes-organicas.htm

