Cheminis izomerizmas yra reiškinys, pastebimas, kai dvi ar daugiau organinių medžiagų turi tą pačią molekulinę formulę, bet skirtingą molekulinę struktūrą ir savybes.
Cheminės medžiagos, turinčios šias savybes, vadinamos izomerais.
Šis terminas yra kilęs iš graikų kalbos žodžių iso = lygus ir tik = dalys, tai yra lygios dalys.
Yra įvairių izomerijos tipų:
- plokščias izomeras: Junginiai identifikuojami plokščiomis struktūrinėmis formulėmis. Jis skirstomas į grandinės izomerizmą, funkcijos izomerizmą, padėties izomerizmą, kompensacinę izomerizmą ir tautomerizmo izomerizmą.
- kosmoso izomeras: Junginių molekulinė struktūra turi skirtingas erdvines struktūras. Jis skirstomas į geometrinę ir optinę izomeriją.
plokščias izomeras
At plokščia izomerija arba konstitucinė izomerija, organinių medžiagų molekulinė struktūra yra plokščia.
Junginiai, turintys šią charakteristiką, vadinami plokščiaisiais izomerais.
grandinės izomeras
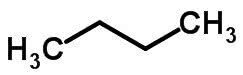
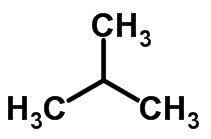
Grandinės izomerija įvyksta, kai anglies atomai turi skirtingas grandines ir tą pačią cheminę funkciją.
Pavyzdžiai:
Funkcija izomerija
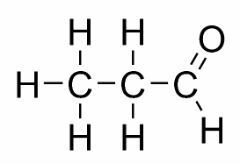
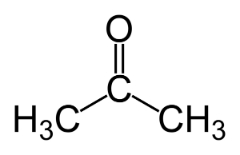
Funkcijos izomerija atsiranda, kai du ar daugiau junginių turi skirtingas chemines funkcijas ir tą pačią molekulinę formulę.
Pavyzdžiai: Šis atvejis būdingas aldehidams ir ketonams.
Padėties izomeras
Padėties izomerija atsiranda, kai junginiai diferencijuojami dėl skirtingų nesočiųjų, išsišakojančių ar funkcinių grupių pozicijų anglies grandinėje. Šiuo atveju izomerai turi tą pačią cheminę funkciją.
Pavyzdžiai:

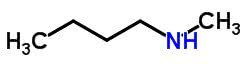
kompensuojantis izomeras
Kompensacinė izomerija arba metamerizmas pasireiškia tos pačios cheminės funkcijos junginiuose, kurie skiriasi pagal heteroatomų padėtį.
Pavyzdžiai:

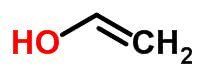
Tautomery
Tautomerizmas arba dinaminė izomerija gali būti laikomi konkrečiu funkcijos izomerizmo atveju. Šiuo atveju vienas izomeras gali pasikeisti į kitą, pakeisdamas elemento padėtį grandinėje.
Pavyzdžiai:

kosmoso izomeras
kosmoso izomerija, dar vadinamas stereoizomerizmu, įvyksta, kai du junginiai turi tą pačią molekulinę formulę ir skirtingas struktūrines formules.
Šio tipo izomerizme atomai pasiskirsto vienodai, tačiau erdvėje užima skirtingas pozicijas.
geometrinis izomeras
geometrinė izomerija arba cis-transas atsiranda nesočiose atvirose grandinėse ir cikliniuose junginiuose. Norėdami tai padaryti, anglies ligandai turi būti skirtingi.

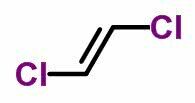
- Kai tie patys ligandai yra toje pačioje pusėje, izomero nomenklatūra gauna priešdėlį cis.
- Kai tie patys ligandai yra priešingose pusėse, nomenklatūra gauna priešdėlį vert.
IUPAC (Tarptautinė grynosios ir taikomosios chemijos sąjunga) rekomenduoja vietoj cis ir trans naudoti priešdėlį raidėmis Z ir E.
Taip yra todėl, kad Z yra pirmoji vokiško žodžio raidė zusammenas, kas reiškia „kartu“. Ir tai yra pirmoji vokiško žodžio raidė entegegen, kas reiškia „priešingai“.
optinis izomeras
optinė izomerija rodo optiškai aktyvūs junginiai. Tai atsitinka, kai medžiagą sukelia kampinis nuokrypis poliarizuotos šviesos plokštumoje.
- Kai medžiaga lenkia optinę šviesą į dešinę, ji vadinama dešiniarankiams.
- Kai medžiaga lenkia optinę šviesą į kairę, medžiaga vadinama levorotary.
Medžiaga taip pat gali egzistuoti dviem optiškai aktyviomis formomis - dekstogra ir levogira. Šiuo atveju jis vadinamas enantiomeras.
Kad anglies junginys būtų optiškai aktyvus, jis turi būti chiralinis. Tai reiškia, kad jų ligandai negali sutapti, nes yra asimetriški.
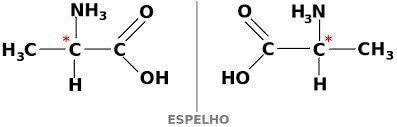
Savo ruožtu, jei junginys turi lygias dalis dekstrogiros ir levorotarinės formos, jie vadinami raceminiai mišiniai. Rateminių mišinių optinis aktyvumas yra neaktyvus.
Taip pat skaitykite:
- Anglis
- Organinė chemija
- Molekulinė formulė
- struktūrinė formulė
Pratimai
1. (Mackenzie 2012) Skaičių B stulpelis, kuriame yra organinių junginių, susiejant juos su A stulpeliu, atsižvelgiant į kiekvienos organinės molekulės izomerijos tipą.
A stulpelis
1. kompensuojantis izomeras
2. geometrinis izomeras
3. grandinės izomeras
4. optinis izomeras
B stulpelis
() ciklopropanas
() etoksi-etanas
() brom-chlor-fluor-metanas
() 1,2-dichlor-etenas
Teisinga skaičių seka B stulpelyje nuo viršaus iki apačios yra
a) 2 - 1 - 4 - 3.
b) 3 - 1 - 4 - 2.
c) 1 - 2 - 3 - 4.
d) 3 - 4 - 1 - 2.
e) 4 - 1 - 3 - 2.
B) 3 - 1 - 4 - 2 alternatyva.
2. (Uerj) Izomerija yra reiškinys, kuriam būdinga tai, kad ta pati molekulinė formulė atspindi skirtingas struktūras.
Atsižvelgiant į plokščią molekulinės formulės izomerizmą C4H8, galime nustatyti šių tipų izomerus:
a) grandinė ir padėtis
b) grandinė ir funkcija
c) funkcija ir kompensacija
d) padėtis ir kompensacija
Alternatyva a) eilutė ir padėtis
3. Propanonas ir izopropenolis yra izomerijos atvejis:
a) metameria
b) funkcijos
c) tautomerijos
d) cis-tran
e) grandinė
Tautomerijos c) alternatyva
Taip pat žiūrėkite: Pratimai apie plokščią izomerizmą