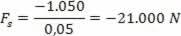Termodinamika yra fizikos sritis, tirianti energijos perdavimą. Ji siekia suprasti šilumos, energijos ir darbo santykius, analizuodama keičiamo šilumos kiekį ir fiziniame procese atliktą darbą.
Termodinaminį mokslą iš pradžių sukūrė mokslininkai, kurie pramoninės revoliucijos laikotarpiu ieškojo būdo, kaip pagerinti mašinas, pagerinant jų efektyvumą.
Šios žinios šiuo metu pritaikomos įvairiose kasdienio gyvenimo situacijose. Pavyzdžiui: šiluminės mašinos ir šaldytuvai, automobilių varikliai ir mineralų bei naftos produktų transformavimo procesai.
Termodinamikos dėsniai
Pagrindiniai termodinamikos dėsniai reguliuoja tai, kaip šiluma tampa darbu, ir atvirkščiai.
Pirmasis termodinamikos dėsnis
Pirmasis termodinamikos dėsnis susijęs su energijos taupymo principas. Tai reiškia, kad energija sistemoje negali būti sunaikinta ar sukurta, tik transformuota.
Pirmąją termodinamikos dėsnį atspindinti formulė yra tokia:

Šilumos kiekis, darbas ir vidinės energijos kitimas yra standartinis matavimo vienetas Džaulė (J).
Praktinis energijos taupymo pavyzdys yra tas, kai žmogus siurbliu pripučia pripučiamą daiktą, jis jėga pumpuoja orą į objektą. Tai reiškia, kad kinetinė energija priverčia stūmoklį nusileisti. Tačiau dalis šios energijos virsta šiluma, kuri prarandama aplinkai.
Heso įstatymas yra konkretus energijos taupymo principo atvejis. Žinoti daugiau!
Antrasis termodinamikos dėsnis
At šilumos perdavimai jų visada būna nuo šilčiausio iki šalčiausio, tai vyksta spontaniškai, bet ne atvirkščiai. Tai reiškia, kad šilumos energijos perdavimo procesai yra negrįžtami.
Tokiu būdu Antrasis termodinamikos dėsnis, neįmanoma šilumos visiškai paversti kita energijos forma. Dėl šios priežasties šiluma laikoma suskaidyta energijos forma.

Fizinis dydis, susijęs su antruoju termodinamikos dėsniu, yra entropija, kuris atitinka sistemos sutrikimo laipsnį.
Taip pat skaitykite:
- Karno ciklas
- Terminis išsiplėtimas
Nulis termodinamikos dėsnis
Nulis termodinamikos dėsnis nagrinėjamos sąlygos gauti terminis balansas. Tarp šių sąlygų galime paminėti medžiagų, kurios daro šilumos laidumą didesnį ar mažesnį, įtaką.
Pagal šį įstatymą
- jei kūnas A yra šiluminės pusiausvyros sąlytyje su kūnu B ir
- jei šis kūnas A yra šiluminės pusiausvyros sąlytyje su kūnu C, tai
- B yra šiluminės pusiausvyros sąlytyje su C.
Susilietus dviem skirtingos temperatūros kūnams, tas, kuris yra šiltesnis, šilumą perduos vėsesniam. Tai lemia temperatūros išlyginimą, pasiekiant terminis balansas.
Jis vadinamas nuliniu dėsniu, nes pasirodė, kad jo supratimas reikalingas pirmiesiems dviem jau egzistavusiems dėsniams, pirmajam ir antrajam termodinamikos dėsniams.
Trečiasis termodinamikos dėsnis
Trečiasis termodinamikos dėsnis tai atrodo kaip bandymas nustatyti absoliutų atskaitos tašką, kuris lemia entropiją. Entropija iš tikrųjų yra antrojo termodinamikos dėsnio pagrindas.
Ją pasiūlęs fizikas Waltheris Nernstas padarė išvadą, kad grynai medžiagai, kurios temperatūra yra nulis, negalima turėti entropijos, kurios apytikslė vertė yra nulis.
Dėl šios priežasties tai yra prieštaringas įstatymas, kurį daugelis fizikų laiko taisykle, o ne įstatymą.
termodinaminės sistemos
Termodinaminėje sistemoje gali būti vienas ar keli giminingi kūnai. Jį supanti aplinka ir Visata vaizduoja išorinę sistemos aplinką. Sistema gali būti apibrėžta kaip: atvira, uždara arba izoliuota.
 termodinaminės sistemos
termodinaminės sistemos
Atidarius sistemą tarp sistemos ir išorinės aplinkos vyksta masės ir energijos perdavimas. Uždaroje sistemoje vyksta tik energijos perdavimas (šiluma), o kai ji yra izoliuota, mainų nėra.
dujų elgsena
Mikroskopinis dujų elgesys yra lengviau apibūdinamas ir interpretuojamas nei kitose fizinėse būsenose (skystos ir kietos). Štai kodėl atliekant šiuos tyrimus dažniausiai naudojamos dujos.
Termodinamikos tyrimuose naudojamos idealios arba tobulos dujos. Tai modelis, kuriame dalelės juda chaotiškai ir sąveikauja tik susidūrus. Be to, laikoma, kad šie susidūrimai tarp dalelių, tarp jų ir indo sienelių yra elastingi ir trunka labai trumpą laiką.
Uždaroje sistemoje idealios dujos suponuoja tokį elgesį, kuris apima šiuos fizinius dydžius: slėgį, tūrį ir temperatūrą. Šie kintamieji apibūdina dujų termodinaminę būseną.
 Dujų elgesys pagal dujų įstatymus
Dujų elgesys pagal dujų įstatymus
Slėgis (p) susidaro judant dujų dalelėms indo viduje. Talpyklos viduje dujų užimama erdvė yra tūris (v). O temperatūra (t) yra susijusi su judančių dujų dalelių vidutine kinetine energija.
Skaityk ir tu Dujų įstatymas ir Dujų tyrimas.
vidinė energija
Vidinė sistemos energija yra fizinis dydis, padedantis įvertinti, kaip vyksta dujų transformacijos. Šis dydis yra susijęs su dalelių temperatūros ir kinetinės energijos kitimu.
Idealios dujos, sudarytos tik iš vieno atomo tipo, turi vidinę energiją, tiesiogiai proporcingą dujų temperatūrai. Tai rodo ši formulė:

Išspręsti termodinamikos pratimai
Klausimas 1
Cilindre su judamu stūmokliu yra 4.0.10 slėgio dujų4N / m2. Kai į sistemą tiekiama 6 kJ šilumos, esant pastoviam slėgiui, dujų tūris padidėja 1,0,10-1m3. Nustatykite atliktą darbą ir vidinės energijos pokytį šioje situacijoje.
Teisingas atsakymas: atliktas darbas yra 4000 J, o vidinis energijos pokytis - 2000 J.
Duomenys:
P = 4,0.104 N / m2
Klausimas = 6KJ arba 6000J
ΔV = 1,0.10-1 m3
T =? ΔU =?
1-as žingsnis: Apskaičiuokite darbą su problemos duomenimis.
T = P. ΔV
T = 4,0,104. 1,0.10-1
T = 4000 J
2-as žingsnis: Apskaičiuokite vidinės energijos kitimą pagal naujus duomenis.
Q = T + ΔU
ΔU = Q - T
ΔU = 6000 - 4000
ΔU = 2000J
Todėl atliktas darbas yra 4000 J, o vidinis energijos pokytis - 2000 J.
2 klausimas
(Pritaikyta ENEM 2011) Variklis gali dirbti tik tuo atveju, jei gauna energijos kiekį iš kitos sistemos. Tokiu atveju degaluose sukaupta energija iš dalies išsiskiria degimo metu, kad prietaisas galėtų veikti. Kai variklis veikia, dalis degimo metu paverstos ar transformuotos energijos negali būti naudojama darbui atlikti. Tai reiškia, kad yra energijos nutekėjimas kita forma.
Remiantis tekstu, variklio veikimo metu vykstančias energijos transformacijas lemia:
a) neįmanoma išleisti šilumos variklio viduje.
b) variklio atliekamas darbas yra nekontroliuojamas.
c) neįmanoma visiškai paversti šilumos į darbą.
d) šiluminės energijos paversti kinetika neįmanoma.
e) galimas kuro energijos suvartojimas yra nekontroliuojamas.
Teisinga alternatyva: c) neįmanoma visiškai paversti šilumos į darbą.
Kaip matyti anksčiau, šilumos negalima visiškai paversti darbu. Variklio veikimo metu dalis šiluminės energijos prarandama, perduodama į išorinę aplinką.
Taip pat žiūrėkite: Termodinamikos pratimai