Aštuoneto taisyklė arba aštuoneto teorija teigia, kad atomų valentiniame apvalkale turi būti aštuoni elektronai, kad jie gautų cheminį stabilumą.
Okteto taisyklė sako:
"cheminiame ryšyje atomo valentiniame apvalkale paprastai būna aštuoni elektronai, panašūs į tauriųjų dujų"
Norint, kad atomai pateiktų visą valentinį sluoksnį, reikia užmegzti cheminius ryšius, kad būtų galima paaukoti, priimti ar dalytis elektronais.
Atomai linkę dalytis elektronais, kol jie įgyja stabilią konfigūraciją, tai yra visą valentinį apvalkalą.
Tokiu būdu atomas pateikia elektroninis pasiskirstymas lygus taurioms dujoms, artimiausioms jų atominiam skaičiui.
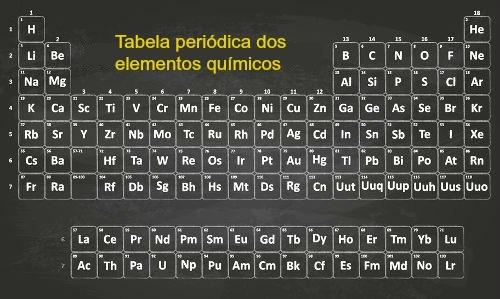
Tauriosios dujos (8A šeima) yra periodinės lentelės elementai, kurių valentiniame apvalkale yra aštuoni elektronai. Vienintelė išimtis yra helis, turintis 2 elektronus.
Kai atomo valentiniame apvalkale yra aštuoni elektronai, jis pasiekia savo stabilumą. Tai reiškia, kad jis nesusijungs su kitais atomais, nes neturi tendencijos gauti ar prarasti elektronus.
Štai kodėl mes neradome junginių, kuriuos sudarė tauriųjų dujų.
Pavyzdžiai
Peržiūrėkite keletą cheminių jungčių, sukurtų siekiant pasiekti aštuonis elektronus, pavyzdžius valentinis sluoksnis:
chloras
O chloras (Cl) valentiniame apvalkale yra atominis skaičius 17 ir septyni elektronai. Taigi, kad jis taptų stabilus, jam reikia elektrono.
Todėl ji turi dalytis elektronų pora per cheminius ryšius. Vienas iš būdų yra prisijungti prie kito chloro atomo ir suformuoti Cl molekulę.2.
Taigi pasiekiami aštuoni valentinės apvalkalo elektronai, tenkinantys okteto taisyklę.

Deguonis
Deguonies valentiniame apvalkale yra šeši elektronai. Kad jis taptų stabilus, jam reikia dar dviejų elektronų, kurie bus gauti per cheminius ryšius.
Deguonis gali jungtis su dviem vandenilio atomais ir sudaryti a molekulė vandens. Tai yra kovalentinis ryšys ir kiekvienas vandenilis dalijasi vienu iš savo elektronų.
Taigi, deguonies valentiniame apvalkale yra aštuoni elektronai.
Norėdami sužinoti daugiau apie chemines jungtis, taip pat skaitykite:
- Cheminiai ryšiai
- Joninės obligacijos
- Kovalentinis ryšys
Išimtys
Kaip ir kiekvienai taisyklei, yra išimčių. Okteto taisyklės išimtys apima elementus, kurių stabilumui reikalingi ne aštuoni elektronai valentiniame apvalkale.
Peržiūrėkite keletą okteto taisyklės išimčių atvejų:
Stabilūs elementai, turintys mažiau nei aštuonis elektronus
Taip pat vadinama okteto susitraukimas, dažniausiai tai atsitinka su elementais iš antrosios periodinės lentelės laikotarpio.
Į šią išimtį įtraukiami elementai, kurių valentiniame apvalkale yra mažiau nei aštuoni elektronai, jau tampa stabilūs.
Pavyzdys yra elementas berilis (Be), jis tampa stabilus, o paskutiniame apvalkale yra tik keturi elektronai.
Boras (B) ir aliuminis (Al) tampa stabilūs, o valentiniame apvalkale yra šeši elektronai.
Stabilūs elementai, turintys daugiau nei aštuonis elektronus
Taip pat vadinama okteto plėtimasis, atsitinka su nemetaliniais elementais nuo trečiojo laikotarpio. Kadangi jie turi daugiau elektronų apvalkalų, jie taip pat turi daugiau orbitalių, skirtų elektronams priimti.
Tokia situacija būna fosforo (P) ir sieros (S) atveju. Fosforas gali priimti iki 10 elektronų, o siera - 12 elektronų.
Taip pat skaitykite:
- elektronegatyvumas
- elektropozityvumas
- Periodinė elementų lentelė