Druskos yra cheminės medžiagos, susidarančios dėl jonų ryšių tarp atomų. Neorganinės druskos funkcija atitinka joninius junginius, kurie turi bent vieną katijoną, išskyrus H+ ir anijonas, išskyrus OH-.
Druskos yra mūsų kasdieniniame gyvenime, plačiai naudojamos maiste ir kitose srityse. Jie yra pavyzdžių druskos:
- Natrio chloridas (NaCl): populiarus kaip valgomoji druska
- Kalcio karbonatas (CaCO3): yra marmuruose ir kalkakmenyje
- Kalcio sulfatas (CaSO4): sudaro mokyklos kreidą ir tinką
- Natrio bikarbonatas (NaHCO3): naudojamas maisto ruošimui, medicinoje ir kaip valymo priemonė
Šios medžiagos paprastai susidaro neutralizuojančios reakcijos metu, kai rūgštis ir bazė reaguoja gamindami druską ir vandenį.
HCl(rūgštis) + NaOH (bazė) → NaCl(druska) + H2O(Vanduo)
Šioje reakcijoje reagentai druskos rūgštis (HCl) ir natrio hidroksidas (NaOH) sudaro natrio chlorido (NaCl) ir vandens (H2O).
Joninių jungčių metu vyksta elektronų perdavimas tarp atomų ir tam vienas iš atomų turi būti metalas, o kitas - nemetalas. Tokiu būdu susidaro teigiamos cheminės rūšys, katijonai, skirti elektronams atiduoti, ir neigiamai įkrauti, anijonai, kurie juos gavo.
Žemiau esančiame paveikslėlyje stebėkite, kaip susidaro natrio chloridas (NaCl).
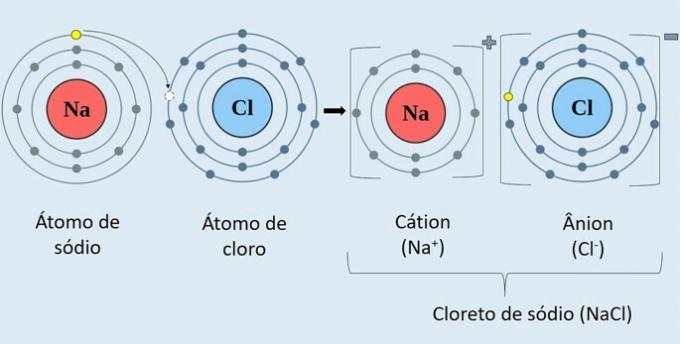
Natrio metalo atomas (Na) elektroną dovanoja chloro atomai (Cl). Taigi susidaro Na katijonas+, kurį sudaro teigiamas natrio jonas ir Cl anijonas-, kuris atitinka neigiamą chloro joną.
žinoti daugiau apie rūgštys ir bazės.
Druskų charakteristikos
Svarbu pažymėti, kad vandeniniame tirpale rūgštys visada išskiria H katijoną+ o pagrindai išleidžia OH anijoną- (Arrenijaus samprata).
Tačiau druskos ne visada turi tą patį katijoną ar anijoną ir dėl šios priežasties neturi aiškiai apibrėžtų funkcinių savybių. Tačiau mes galime pasakyti, kad apskritai:
- Jie yra joniniai junginiai (susidaro iš jonų, o ne iš molekulių);
- Daugeliui būdingas sūrus skonis (beveik visada nuodingas);
- Jie yra kieti ir kristaliniai;
- Laido elektros srovę;
- Jie tirpsta ir verda aukštoje temperatūroje;
- Tirpsta vandenyje (išimtys: kai kurie sulfidai; chloridai, bromidai ir jodidai su Ag katijonais+, hg22+ ir Pb2+, tarp kitų).
Taip pat skaitykite apie cheminės funkcijos.
Druskų klasifikacija ir nomenklatūra
Pagal druskos susidarymo reakcijos būdą jos skirstomos į trijų tipų:
Neutralios arba normalios druskos
Viso neutralizavimo reakcija (visos H reakcijos+ rūgšties ir viso OH- pagrindo). Šios druskos, ištirpusios vandenyje, nekeičia pH.
Pavyzdžiai:
NaOH (bazė) + HCl (rūgštis) → NaCl (įprasta druska) + H2O
3NaOH (bazė) + H3Dulkės4 (rūgštis) → Na3Dulkės4 (normali druska) + 3H2O
Normalių druskų pavadinimas: druskos pavadinimas kilęs iš rūgšties anijono, kurio galas yra, pavadinimo _hidras arba _oso arba _ico bus pakeistas atitinkamai: _eto ou_ito arba _act ir bazinis katijonas.
Druska = (anijono pavadinimas) + priesaga eto / ito / aktasį (katijono pavadinimas).
Taigi:
- rūgštis chlorashidraulinis (HCl) + hidroksidas natrio (NaOH) → chlorasetonatrio (NaCl) + vanduo
- rūgštis nitrataskaulas(HNO2) + hidroksidas kalio(KOH) → nitrataslabai kalio(KNO2) + vanduo
- rūgštis ortofosforasich (2val3Dulkės4) + hidroksidas kalcio(3Ca (OH)2 → ortofosfasasaktas kalcio [Čia3(Dulkės4)2] + vanduo (6H2O)
Rūgštinės druskos arba vandenilio druskos
Dalinė rūgščių neutralizavimo reakcija (kai ne visi H+ rūgšties reaguoja, todėl druskos struktūroje yra vienas ar daugiau jonizuojamų vandenilių iš rūgšties).
Pavyzdys:
NaOH (bazė) + H2TIK4 (rūgštis) → NaHSO4 (rūgštinė druska) + H2O
Rūgščių druskų pavadinimas: panašus į įprastas druskas, bet nurodant H skaičių+ priešdėliais mono, di, triir kt.
Sal = H skaičiaus priešdėlis+ + (anijono pavadinimas) + priesaga eto / ito / aktasį (katijono pavadinimas).
rūgštis sierosich (H2TIK4) + hidroksidas natrio(NaOH) → monohidrogenassierosaktasį natrio (NaHSO4) + vanduo
rūgštis ortofosforasich (H3Dulkės4) + hidroksidas natrio(NaOH) → dihidrogenas-ortofosfasaktas natrio (NaH2Dulkės4) + vanduo
Bazinės druskos arba hidroksi druskos
Dalinės bazės neutralizavimo reakcija (jei ne visi hidroksilai sureaguoja, druskos struktūroje yra vienas ar keli hidroksilai).
Pavyzdys:
Ca (OH)2 (bazė) + HCl (rūgštis) → Ca (OH) Cl (bazinė druska) + H2O
Pagrindinių druskų pavadinimas: panašus į įprastas druskas, bet nurodantis OH skaičių- savo struktūroje.
Sal = OH skaičiaus priešdėlis- + (anijono pavadinimas) + priesaga eto / ito / aktasį (katijono pavadinimas).
rūgštis chlorashidraulinis (HCl) + hidroksidas kalcio [Ca (OH)2] → monohidroksichloraseto kalcio [Ca (OH) Cl] + vanduo
rūgštis chlorashidraulinis (2HCl) + hidroksidas aliuminis [Al (OH)3] → monohidroksichlorasetoį aliuminis [Al (OH) Cl2] + vanduo
Dvigubos arba mišrios druskos
Di, tri ar tetrabazės reakcija su skirtingomis bazėmis (dviguba druska katijonui) arba di, tri ar tetrabazės reakcija su skirtingomis rūgštimis (dviguba druska anijonui).
Pavyzdžiai:
Kalbant apie katijoną:
H2TIK4 (rūgštis) + KOH (bazė) + NaOH (bazė) → KNaSO4 (dvigubas kalio ir natrio sulfatas) + 2H2O
H3Dulkės4 (triacidas) + 2KOH (bazė) + NaOH (bazė) → K2NaPO4 (natrio dikalio ortofosfatas)
Kalbant apie anijoną:
Ca (OH)2 (dibazė) + HBr (rūgštis) + HCl (rūgštis) → CaBrCl (kalcio chlorido bromidas) + 2H2O
Al (OH)3 (tribazė) + H2TIK4(rūgštis) + HCl (rūgštis) → Al (SO4) Cl (aliuminio chlorido sulfatas) + 3H2O
Žinokite pagrindinį neorganinės funkcijos ir būtinai patikrinkite stojimo egzamino klausimus šia tema, komentuodami rezoliuciją: neorganinių funkcijų pratimai.