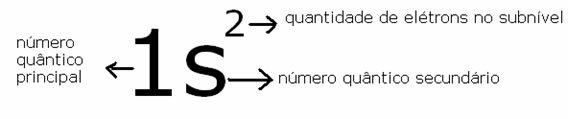
Vienas iš cheminių elementų organizavimo būdų yra šeimos, kurios atitinka vertikalias periodinės lentelės sekas.
At 18 stulpelių lentelės elementus grupuoja pagal cheminių savybių panašumus.
Cheminių elementų suskirstymas į šeimas buvo praktinis būdas įvairiai rastai informacijai struktūrizuoti ir paprastam pateikimui.
Siekiant palengvinti cheminio elemento buvimą, šeimos buvo nurodytos nuo 1 iki 18 taip:
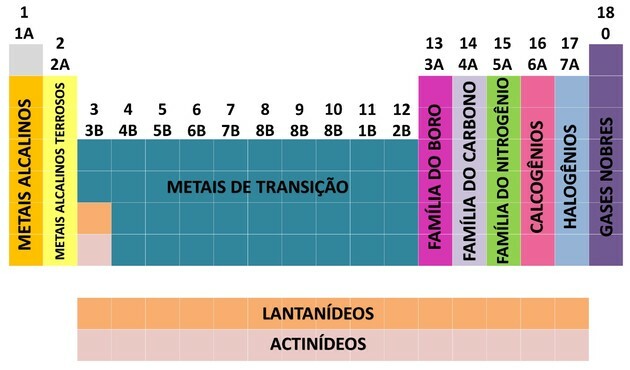
Prisidėjus daugeliui mokslininkų ir įvairiais bandymais sutvarkyti duomenis, periodinė lentelė vystėsi, nustatydama tvarką elementams sutvarkyti.
Šeimų nomenklatūra
- Lentelėje esančios šeimos buvo suskirstytos į A (reprezentatyvus) ir B (perėjimas), identifikuojamos raidėmis ir skaičiais.
- Tu reprezentatyvūs elementai 0, 1A, 2A, 3A, 4A, 5A, 6A ir 7A šeimos susirašinėja.
- Tu perėjimo elementai 1B, 2B, 3B, 4B, 5B, 6B, 7B ir 8B šeimos susirašinėja.
- Nustatant Tarptautinę grynosios ir taikomosios chemijos sąjungą (IUPAC), šeimos buvo nustatytos grupės nuo 1 iki 18.
Periodinė lentelė ir elektroninis paskirstymas
Panašumai tarp tos pačios šeimos elementų atsiranda dėl to, kad atomo valentinių elektronų skaičius pagrindinėje būsenoje yra vienodas tam tikros grupės nariams.
Pavyzdžiui:
| 1 grupė | Eletroninis pasiskirstymas |
|---|---|
| 3skaityti | 2-1 |
| 11At | 2-8-1 |
| 19K. | 2-8-8-1 |
| 37Rb | 2-8-18-8-1 |
| 55Cs | 2-8-18-18-8-1 |
| 87Kun | 2-8-18-32-18-8-1 |
1 grupės atomų elektronai pasiskirstę per daugiau nei vieną energijos lygį, tačiau visi turi valentinį elektroną.
Tuo mes stebime, kad elektroninis pasiskirstymas pagrindo būsenos atomo, mes randame jo padėtį periodinėje lentelėje.
reprezentatyvūs elementai
Reprezentaciniai elementai pasižymi santykinai mažiau sudėtingu cheminiu elgesiu nei pereinamieji elementai ir sudaro daugumą aplink mus esančių medžiagų.
Kai kurioms tipinių elementų šeimoms suteikiami specialūs pavadinimai, kaip parodyta žemiau:
Grupė |
Šeima | konkretus vardas | Vardo kilmė | Elementai | elektroninė konfigūracija |
|---|---|---|---|---|---|
| 1 | 1A | šarminiai metalai | iš lotynų kalbos šarmas, kuris reiškia „augalų pilka“. | Li, Na, K, Rb, Cs ir Fr | mus1 |
| 2 | 2A | šarminių žemių metalai | Terminas „žemiškasis“ reiškia „egzistuojantį žemėje“. | Būkite, Mg, Ca, Sr, Ba ir Ra | mus2 |
| 13 | 3A | boro šeima | Pirmojo šeimos elemento vardas. | B, Al, Ga, In, Tl ir Nh. | mus2np1 |
| 14 | 4A | anglies šeima | Pirmojo šeimos elemento vardas. | C, Si, Ge, Sn, Pb ir Fl. | mus2np2 |
| 15 | 5A | Azoto šeima | Pirmojo šeimos elemento vardas. | N, P, As, Sb, Bi ir Mc. | mus2np3 |
| 16 | 6A | Chalkogenai | iš graiko khalks, nes jie yra elementai, esantys vario rūdose. | O, S, Se, Te, Po ir Lv. | mus2np4 |
| 17 | 7A | Halogenai | Graikų išraiška, reiškianti druskos formuotojus | F, Cl, Br, I, At ir Ts. | mus2np5 |
| 18 | 0 | Tauriosios dujos | Buvo manoma, kad jis nereaguoja su kitomis medžiagomis. | Jis, Ne, Ar, Kr, Xe, Re ir Og. | 1s2 (Jis) ar mes2np6 |
Per lentelę galime pamatyti, kad:
- Aukščiau pateikti elementai yra klasifikuojami kaip tipiniai, nes jie turi daugiausiai energijos turinčio elektrono s arba p pakopoje.
- Elektronai pasiskirstę energijos lygiuose, o n reiškia tolimiausią atomo lygį pagrindinėje būsenoje.
- Reprezentatyvūs elementai pagal IUPAC rekomendaciją priklauso 1,2,13,14,15,16,17 ir 18 grupėms ar šeimoms.
O vandenilis jis klasifikuojamas atskirai nuo kitų elementų. Net su 1s elektronine konfigūracija1, jis nėra 1 grupės narys, pateikiantis vienaskaitos elgesį.
perėjimo elementai
Perėjimo elementai atitinka 3–12 grupes. Šį pavadinimą jie gauna, nes turi tarpines savybes tarp 1 ir 2 grupių ir tipiškų nemetalinių elementų.
Tu pereinamieji metalai IUPAC apibrėžia kaip:
Pereinamasis elementas turi neišsamų d pakopą arba gali suformuoti katijonus su nebaigtu d pakopu.
Kai energingiausias atomo elektronas pagrindinėje būsenoje yra neužbaigtame d pakopoje, jis apibūdinamas kaip išorinis perėjimas.
Lantanidai ir aktinidai yra vidiniai perėjimo elementai, nes jie turi bent vieną nepilną f pakopą.
Kai elementai turi elektronus, užpildančius d arba f orbitales, jie pasižymi panašiomis savybėmis ir gali būti skirstomi į elementus išorinis ar vidinis perėjimas.
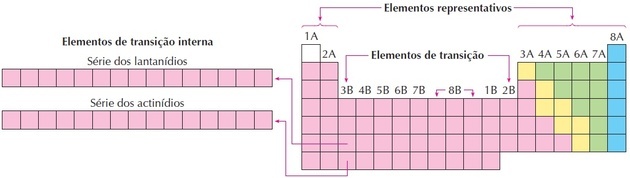
Kaip matome paveikslėlyje, 8B šeima atitinka 3 stulpelius, tai yra 8, 9 ir 10 grupės, kurios buvo sugrupuotos taip, nes turi panašias savybes.
Pagrindinės šeimų savybės
Žemiau esančioje lentelėje pateikiamos pagrindinės periodinės lentelės grupių savybės:
| Grupė | funkcijos | sudėtinės medžiagos dažniau |
įvykių |
|---|---|---|---|
| 1 | Tvirtas ir blizgus aplinkos sąlygomis. Labai reaktyvūs, minkšti ir geri elektros laidininkai. | Druskos, hidroksidai ir oksidai |
Reaguokite su halogenais ir suformuokite druskas. |
| 2 | Mažiau reaktyvus ir sunkesnis nei 1 grupė. Sidabro kietosios medžiagos, turinčios gerą laidumą. | Druskos, hidroksidai ir oksidai |
Susidaro druskos ir oksidai. |
| Nuo 3 iki 12 | Jie formuoja kompleksus. Jie yra kietos ir trapios metalinės kietosios medžiagos, išskyrus gyvsidabrį, kuris yra skystis. | Druskos, oksidai ir kompleksai. Pvz.: AgNO3, TiO ir [Cr (OH)3(H2O)3] |
Mineraluose oksidų pavidalu. |
| 13 | Kietosios medžiagos aplinkos sąlygomis, sidabras, išskyrus borą. | Oksidai Pvz.: B2O3 |
Mineraluose oksidų pavidalu. |
| 14 | Kietas aplinkos sąlygomis. | C ir Si atomai gali išsidėstyti grandinėmis ir gaminti labai įvairias medžiagas. | Gyvuose organizmuose ir silikatų ar oksidų pavidalu. |
| 15 | Kietosios medžiagos, išskyrus azotą, kuris aplinkos sąlygomis yra dujinis. | Oksidai ir rūgštys Pvz.: NE2 ir H3Dulkės4 |
Atmosfera, gyvi organizmai ir mineralai. |
| 16 | Kietosios medžiagos, išskyrus deguonį, kuris aplinkos sąlygomis yra dujinis. | Sulfidai ir oksidai Pvz.: ZnS ir SiO2 |
Atmosfera, gyvi organizmai ir mineralai. |
| 17 | Jie formuoja diatomines molekules ir yra labai reaktyvūs. Jie yra blogi elektros ir šilumos laidininkai. Jie yra agresyvūs gyvoms būtybėms ir aplinkai. | Rūgštys ir druskos. Pvz.: HCl ir KBr |
Yra medžiagose organinis ir mineralinis. |
| 18 | Jie yra labai stabilūs ir yra dujų pavidalu. | Jie beveik nesudaro sudėtinių medžiagų. | Dujos atmosferoje. |
Cheminės ir fizinės savybės išskiria vieną šeimą nuo kitos. Kaip matėme, cheminės savybės yra susijusios su elektronai valentingumoir per juos atomas sąveikauja su kitu, būdamas atsakingas už cheminį elgesį ir cheminiai ryšiai susiformavo.
Tos pačios grupės elementų fizinės savybės gali skirtis priklausomai nuo atominio skaičiaus ir masės.
Pratimai
Dabar, kai žinote šiek tiek daugiau apie periodinių lentelių šeimas, patikrinkite savo žinias ir sužinokite, ko išmokote.
1) Apsvarstykite šį periodinės lentelės ištrauką.
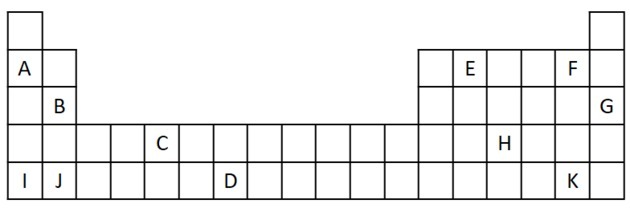
a) Įvardykite du elementus, turinčius du valentinius elektronus.
b) Nurodykite elementą, kuris smarkiai reaguoja su vandeniu, gamindamas metalo hidroksidą.
c) Nurodykite nereaguojantį elementą.
d) Nurodykite du elementus, kurie kartu su šarminiais metalais sudaro druskas.
Atsakyti:
a) B ir J
Du valentiniai elektronai atitinka 2 grupę, kuri turi ns elektronų konfigūraciją2 ir pratybose jiems atstovauja B ir J.
b) A, B, I arba J.
A ir aš atstovaujame 1 šeimos elementams; B ir J yra iš 2 šeimos. Kaip matėme savybių lentelėje, 1 ir 2 grupės elementai yra labai reaktyvūs ir gali sudaryti hidroksidus, kaip parodyta pavyzdžiuose: KOH ir Mg (OH)2.
c) G
Kaliningosios dujos yra labai stabilios, todėl nėra labai reaktyvios. G raidė lentelėje įterpiama kaip šios šeimos elementas.
d) F ir K
Halogenai reaguoja su šarminiais metalais ir susidaro druskos. Dažniausias to pavyzdys yra valgomoji druska NaCl.
2) Šiame paveiksle pavaizduoti trys cheminiai elementai, iš kairės į dešinę, ličio, natrio ir kalio.

Pasirinkite parinktį, kuri tinkamai užpildo kiekvieną iš šių teiginių.
1.1) „Galime sakyti, kad ličio, natrio ir kalio…
(A)… priklauso tam pačiam laikotarpiui. “
(B)... turi tą patį atominį skaičių. “
(C)… priklauso tai pačiai grupei. “
(D)… turi tą patį masės skaičių. “
1.2) "Ličio, natrio ir kalio elementai ...
(A)... pasižymi labai panašiomis cheminėmis savybėmis “.
(B)... pasižymi labai skirtingomis cheminėmis savybėmis. “
(C)… yra nemetalai. “
(D)… reaguoja su vandeniu, kad susidarytų rūgštūs tirpalai. “
Atsakymai:
1.1) (C) priklauso tai pačiai grupei.
1.2) (A) turi labai panašias chemines savybes.
Šią informaciją galime gauti peržiūrėję periodinę lentelę arba elektroniškai platindami elementus ličio, natrio ir kalio. Pamatysime, kad visi trys turi elektroną valentiniame apvalkale ir kadangi jie yra tos pačios grupės dalis, cheminės savybės yra labai panašios.
3) Apsvarstykite šią lentelę, kurioje pavaizduoti kai kurių cheminių elementų atomų skaičiai ir elektroniniai pasiskirstymai.
| Elementas | cheminis simbolis | atominis skaičius | Eletroninis pasiskirstymas |
|---|---|---|---|
| Ličio | skaityti | 3 | 2,1 |
| Berilis | būti | 4 | 2,2 |
| Fluoras | F | 9 | 2,7 |
| neonas | Huh | 10 | 2,8 |
| chloras | Cl | 17 | 2,8,7 |
| argonas | Oro | 18 | 2,8,8 |
| Kalis | K. | 19 | 2,8,8,1 |
| Kalcis | Čia | 20 | 2,8,8,2 |
Nurodykite kiekvieno elemento grupę.
Atsakyti:
Ličio ir kalio: 1 grupė. (Jie turi elektroną valentiniame apvalkale).
Berilis ir kalcis: 2 grupė. (Jie turi du elektronus valentiniame apvalkale).
Fluoras ir chloras: 17 grupė. (Jie turi septynis elektronus valentiniame apvalkale).
Neonas ir argonas: 18 grupė. (Jie turi aštuonis elektronus valentiniame apvalkale).
Patikrinkite stojamojo egzamino klausimus komentuodami rezoliuciją Periodinės lentelės pratimai ir nepaskelbti klausimai šia tema Periodinės lentelės organizavimo pratimai.