Trečiasis termodinamikos dėsnis susijęs su materijos elgesiu, kai entropija artėja prie nulio.
Pagal šį dėsnį, kai tik sistema yra termodinaminėje pusiausvyroje, jos entropija artėja prie nulio.
Antrasis termodinamikos dėsnis susijęs su entropija. Vėliau trečiasis įstatymas pasirodo kaip a bandyti nustatyti absoliutų atskaitos tašką, kuris lemia entropiją.
Waltheris Nernstas (1864–1941) buvo fizikas, nagrinėjęs principus, kurie sudarė pagrindą trečiajam termodinamikos dėsniui.
Anot Nernsto, entropija turėtų minimalią vertę, jei grynos medžiagos temperatūra būtų lygi arba artėtų prie absoliutaus nulio.
Tam Nernstas pasiūlė žemiau pateiktą formulę, kuri rodo, kad entropijos (ΔS) ir temperatūros (T) kitimas linkęs į minimalias vertes, tai yra 0:
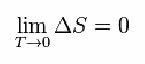
Bet kas yra Entropija?
Entropija tai būdas, kaip molekulės organizuojasi sistemoje. Ši organizacija virsta sutrikimu ne painiavos, o molekulių judėjimo ir sujaudinimo prasme.
Kuo daugiau molekulių gali judėti, tuo daugiau neorganizuotos, tuo daugiau entropijos.
Iš pradžių Nernstas teigė, kad jo pasiūlyta entropija bus įmanoma tik esant tobuliems kristalams.
Galiausiai jis padarė išvadą, kad absoliutaus nulio temperatūra neegzistuoja, todėl trečiasis dėsnis tampa prieštaringu dėsniu.
Taigi daugeliui fizikų tai ne įstatymas, o taisyklė.
Po tiek metų (nuo 1912 m.) Mokslininkai bando pasiekti šią temperatūrą ar tas temperatūras, kurios artėja vis arčiau absoliutaus nulio. Taigi jie atrado, kad tai įmanoma tik dujomis, išmetant bet kokią kietos ar skystos būsenos medžiagą.
Taip pat skaitykite:
- Nulis termodinamikos dėsnis
- Pirmasis termodinamikos dėsnis
- Antrasis termodinamikos dėsnis
- Termodinamikos pratimai


