O atominis spindulys elementų yra periodinė savybė, nustatanti atomo spindulį, kuris skiriasi priklausomai nuo elemento padėties periodinėje lentelėje.
Taigi, jie gali didėti ir mažėti kaip atominis skaičius (Z) elemento, kuris atitinka protonų, esančių atomų branduolyje, skaičių.
Apibendrinant galima pasakyti, kad atomo spindulys atitinka pusę atstumo tarp dviejų kaimyninių atomų branduolių, išreiškiamas taip:
r = d / 2
iš kur:
r = spindulys
d = tarpbranduolinis atstumas
Paprastai atominis spindulys matuojamas pikometrais (pm), skaitiklio daliniu kartotiniu (1 pikometras = 10-12 m.). Atkreipkite dėmesį, kad kai atskaitos taškas yra ne atomas, o jonas, radęs spindulys yra joninis spindulys.
Atomo spindulio kitimas
Periodinėje lentelėje atomo spindulio augimą galima pamatyti šiame paveiksle:
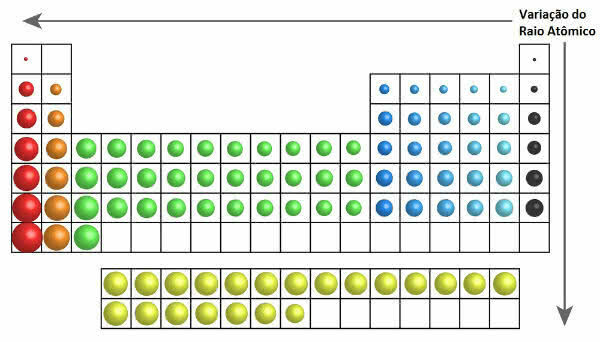 Atominio spindulio kitimas periodinėje lentelėje
Atominio spindulio kitimas periodinėje lentelėje
Taigi vertikaliai (šeimos ar grupės) atomo spindulys didėja iš viršaus į apačią. Horizontale (periodai) jie didėja iš dešinės į kairę.
Žr. Atvirkštinį variantą Elektroninis bendrumas ir elektronegatyvumas.
Jonizacijos energija
jonizacijos energija (arba potencialas) tai taip pat yra periodinė savybė, lemianti elektronui perkelti reikalingą energiją, kuri išreiškiama elektronų voltais (eV).
Taip pat skaitykite: Periodinės savybės.
Patikrinkite stojamojo egzamino klausimus komentuodami rezoliuciją: Periodinės lentelės pratimai.

