Chloridai yra tie joniniai junginiai, kuriuose yra anijonas Cℓ-1.
Chloras priklauso 17 arba 7A šeimai, jo atominis skaičius yra lygus 17, o valentiniame apvalkale (atomo išoriniame elektronų apvalkale) yra 7 elektronai. Pagal taisyklė okteto, kad jis būtų stabilus, paskutiniame apvalkale turi būti 8 elektronai, todėl reikia gauti dar vieną elektroną. Kai tai atsitinka, tai yra, kai jis gauna elektroną, paprastai iš joninio ryšio su metalu, susidaro â.jonų chloridas (Cℓ-1), metalas, atsisakęs elektrono, tampa katijonu, o susidariusi medžiaga yra joninė.
Chloridai yra druskos, gautos reaguojant bazei su druskos rūgštimi (HCℓ(čia)). Pagrindas suteikia katijoną, o druskos rūgštis - chlorido joną:
Bendroji bazė + druskos rūgštis → Chloridas + vanduo
ÇOH + HCℓ → ÇCℓ + H2O
Visi chloridai klasifikuojami kaip neorganinės druskos, nes vandeninėje terpėje jie išskiria kitokį nei H katijoną+ ir išskirkite chlorido anijoną, o ne hidroksilą (OH-).
Chloridų nomenklatūroje visada laikomasi šios taisyklės:
Chloridas +de + (elemento, susieto su chloru, pavadinimas). At jūsų formulės yra suformuotos keičiant jonų krūvius į indeksus (skaičius, esantis elemento simbolio apačioje, dešinėje, nurodantis to elemento atomų skaičių, kuris jungiasi).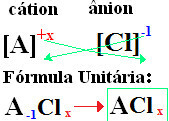
jei indeksas yra „1“, nereikia jo rašyti į formulę, kaip parodyta žemiau:
At+1 Cℓ-1 → At1Cℓ1 → AtCℓ: natrio chloridas;
K.+1 Cℓ-1 → K.Cℓ: kalio chloridas;
Čia+2 Cℓ-1→CaCℓ2: kalcio chloridas;
Ba+2 Cℓ-1→ Bčia2: bario chloridas;
Aℓ+3 Cℓ-1→ACℓ3: aliuminio chloridas.
Tačiau, kaip paaiškinta tekste „Grupės joninės medžiagos: chloridas, karbonatas, nitratas ir sulfatas“, Kaip ir visoms joninėms medžiagoms, chloridų vienetinės formulės nėra izoliuotos gamtoje, nes jų jonai traukia vienas kitą ir formuoja kristalines groteles.
Pagrindinis chlorido pavyzdys, kurį turime kasdieniame gyvenime, yra natrio chloridas, NaCℓ, valgomoji druska. Pažiūrėkite į joninį ryšį, dėl kurio jis susidaro (natris chlorui atiduoda elektroną) ir žemiau šios druskos kristalinės grotelės:
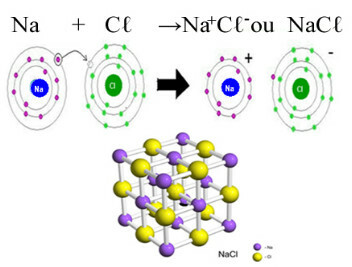
Natrio chlorido kristalinėje gardelėje kiekvienas anijonas Cℓ- yra apsuptas 6 katijonais Na+ ir atvirkščiai, taigi šios kristalinės gardelės koordinacinis skaičius yra 6.
Visi chloridai yra kietosios medžiagos aplinkos sąlygomis ir gana tirpsta vandenyje, yra viena iš labiausiai paplitusių druskų, randamų mūsų kasdieniame gyvenime, turint omenyje, kad keletas jų yra ištirpusių mineraliniame vandenyje, geriamajame vandenyje, vandentiekio vandenyje, upėse, jūrose, tarp jų kiti. Tarp išimčių, vandenyje netirpių chloridų, yra sidabro chloridas (AgCℓ - parodyta toliau pateiktame paveikslėlyje) iš švino, vario ir gyvsidabrio junginiai.

Vandenyje netirpus sidabro chloridas *
Cℓ jonai-1 iš chloridų, kuriuos mes praryjame, daugiausia druska, žuvis ir mėsa, yra svarbios kai kurioms žmogaus kūno funkcijoms, nes jos yra pagrindinis tarpląstelinis anijonas, yra sultyse skrandį, reguliuoja kūno skysčius, tokius kaip vandens pasiskirstymas organizme, ir palaiko plazmos osmosinį slėgį ir neutralumą elektrinis.
Jo trūkumas gali sukelti nerimą, viduriavimą ir kraujotakos sutrikimus. Jo perteklius išsiskiria su šlapimu (vidutiniškai kiekvienas žmogus per dieną išskiria apie 4 g chlorido), prakaitu ir išmatomis.
*Vaizdo kreditas: Autorius: Danny S. / Vaizdas išgautas iš: „Wikimedia Commons“
Jennifer Fogaça
Baigė chemiją

