Sumaišius du sprendimus, nesvarbu, ar jie skirtingi, ar ne, pirmiausia reikia išanalizuoti, ar tarp jų yra reakcija. Pvz., Jei vandens tirpalą sumaišysime su cukrumi (vandeninis sacharozės tirpalas) su vandens su druska (sūrymu) tirpalu, gausime tirpalų maišymas be cheminių reakcijų.
Tas pats atsitinka, jei sumaišome du skirtingos koncentracijos natrio chlorido (NaCl) tirpalus. Tokiu atveju taip pat nebus jokios reakcijos. Tada mes galime apibrėžti šį pavyzdį kaip a to paties tirpalo tirpalai maišomi be jokios cheminės reakcijos, kur pirmasis pavyzdys yra a skirtingų tirpalų tirpalų maišymas be cheminės reakcijos.
Abiem atvejais cheminis tirpalų komponentų sudėtis nepakis., tačiau kai kuriuos kiekybinius aspektus teks perskaičiuoti.
Norėdami suprasti, kaip mes galime nustatyti molinę koncentraciją (molingumą) ir bendrą tirpalų mišinio koncentraciją be reakcijos, pažiūrėkime dviejų paminėtų atvejų skiriamąją gebą:
1) To paties tirpalo mišinys be cheminės reakcijos:

Įsivaizduokite, kad sumaišome du natrio chlorido tirpalus, kurių vienas yra 2,0 g / l koncentracijos 60,0 ml tirpalo, o kitas - 2,5 g / l 80 ml tirpalo tūrio.
Kadangi reakcija nevyksta, tiek masė, tiek tūris yra tik pradinių masių ir tūrių suma:
m (tirpalas) = m1 (NaCl) + m2 (NaCl)
m1 (NaCl) = v. Cm2 (NaCl) = v. Ç
m1 (NaCl) = 0,06 l. 2,0 g / l m2 (NaCl) = 0,08 l. 2,5 g / l
m1 (NaCl) = 0,1 g2 (NaCl) = 0,2 g
m (tirpalas) = 0,1 g + 0,2 g
m (tirpalas) = 0,3 g
v (tirpalas) = v1 (NaCl) + v2 (NaCl)
v (tirpalas) = (60 + 80) ml
v (tirpalas) = 140 ml = 0,14 l
Tada koncentraciją galima gauti naudojant šiuos duomenis:
C (tirpalas) = m (tirpalas)
v (tirpalas)
C (tirpalas) = 0,3 g
0,14 l
C (tirpalas)≈ 2,14 g / l
2) skirtingų tirpalų tirpalų mišinys be cheminės reakcijos:
Pavyzdžiui, paimkite 500 ml sacharozės (C12H22O11), kurio koncentracija iš pradžių buvo 18,0 g / l, su 1 l sūraus vandens tirpalo (vandeninis natrio chlorido tirpalas - NaCl), kurio koncentracija buvo 100,0 g / l.
Nesustokite dabar... Po reklamos yra daugiau;)
Sumaišius, koks buvo maišymo metu susidariusio tirpalo moliškumas, įprasta koncentracija, masė ir tūris?
Kadangi cheminės reakcijos nebuvo, C masės12H22O11 ir NaCl lieka nepakitę. Pradines masės vertes galima pasiekti taikant paprastą trijų taisyklę, naudojant reakcijos koncentracijas.
18,0 g 1 l
m (C12H22O11) 0,5 l
m (C12H22O11) = 9,0 g
m (NaCl) 100,0 g
Masę taip pat galima gauti pagal formulę:
m = v. Ç
m (C12H22O11) = 0,5 L. 18g / l
m (C12H22O11) = 9,0 g
m (NaCl) = 1 L. 100,0 g / l
m (NaCl) = 100,0 g
Taigi bendra tirpalo masė yra dviejų masių suma:
m (tirpalas) = m (C.12H22O11) + m (NaCl)
m (tirpalas) = 109,0 g
Apimtis yra tiesiog pradinių apimčių suma, taigi mes turime:
v (galutinis tirpalas) = v (C.12H22O11) + v (NaCl)
v (galutinis tirpalas) = (0,5 + 1) L
v (galutinis tirpalas) = 1,5 l
Galutinė koncentracija pasiekiama atskirai apskaičiuojant kiekvieno tirpinio koncentraciją. Kadangi jie nereaguoja tarpusavyje ir jų masės nesikeičia, galime naudoti šią koncentracijos formulę:
C = m
v
pradinis = mpradinis galutinis c = mGalutinis
vpradinis vGalutinis
mpradinis = mGalutinis
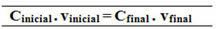
C (C12H22O11) =?
Çpradinis. vpradinis = CGalutinis. vGalutinis
18,0 g / l. 0,5 l = CGalutinis .1,5 l
C (C12H22O11) Galutinis = 6,0 g / l
C (NaCl) =?
Çpradinis. vpradinis = CGalutinis. vGalutinis
100,0 g / l. 1 L = C galutinis, 1,5 L
C (NaCl)Galutinis = 66,67 g / l
Santykį, nustatytą šiai bendros koncentracijos formulei, taip pat galima apskaičiuoti moliarumą (Mi. vi = Mf. vf) ir masės koncentracijai pagal masę (T antraštėi. vi = T.f. vf).
Jennifer Fogaça
Baigė chemiją