At molekulės tai yra struktūros, turinčios nustatytą molinę masę ir santykinai mažą ir tikslų atomų, sujungtų kovalentiškai, tai yra dalijantis elektronais, skaičių.
Žr. Tris pavyzdžius:
- Deguonies dujos: kiekviena jos molekulė susidaro dvigubu ryšiu, tai yra dalijant dvi elektronų poras tarp dviejų deguonies atomų (O2);
- Vanduo: jis susidaro iš H molekulių2O. Tai reiškia, kad kiekviena molekulė turi du vandenilio atomus, dalijančius elektronų porą, kurių kiekvienas turi deguonies atomą.
- Metanas: šį junginį sudaro CH molekulės4, kuriame keturi vandenilio atomai kovalentiškai susijungia su vienu anglies atomu.
Molekulinės medžiagos turi keletą būdingų savybių, tokių kaip:
- Skirtas tirpumas vandenyje ir kituose tirpikliuose;
- Jie gali pateikti save trijose fizinėse būsenose;
- Paprastai tariant, jie yra kieti ir skysti elektros izoliatoriai.
Visas molekules sudaro nemetaliniai elementai, tai yra, jie apima tik vandenilį, nemetalus ir pusmetalius. Šie elementai taip pat gali sudaryti medžiagas, kurios yra tik kietos būsenos ir kurių savybės labai skiriasi nuo molekulių savybių. tai yra
makromolekulės.Makromolekulės, dar žinomos kaip kovalentinės kietosios medžiagos arba kovalentinės tinklo kietosios medžiagos,jie yra struktūros, kurių molinė masė yra labai didelė ir netiksli, be to, jas formuoja didelis ir neapibrėžtas kiekis atomų, kurie kovalentiškai susijungia, kad susidarytų trimatės grotelės. Makromolekulės sudaro kovalentiniai kristalai arba atominiai kristalai.
Nesustokite dabar... Po reklamos yra daugiau;)
Pavyzdžiui, anglies atomai gali dalytis elektronais įvairiais būdais ir sudaryti daug skirtingų paprastų medžiagų. Šiai savybei, kurią tas pats cheminis elementas turi sudaryti dvi ar daugiau skirtingų paprastų medžiagų, suteikiamas pavadinimas alotropija.
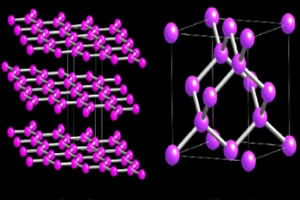
Dvi alotropinės anglies atmainos, sudarančios makromolekules, yra Deimantas ir grafitas. Žemiau esančiuose paveikslėliuose galite pamatyti, kad deimanto atveju kiekvienas anglies atomas prisijungia prie keturių kitų anglies atomų ir sukuria tetraedrinės struktūros makromolekulę.

Tuo tarpu grafito struktūrą sudaro šešiakampiai žiedai, esantys toje pačioje plokštumoje. Anglies atomai sudaro vieną dvigubą ir dvi viengubas jungtis.

Tačiau makromolekules sudaro ne tik vieno tipo elementai; jie taip pat gali būti suformuoti iš skirtingų cheminių elementų atomų.
Pavyzdys yra silicio dioksidas (kvarcas), kurio makromolekulėse kiekvienas silicio atomas yra apsuptas keturiais anglies atomais, o kiekvienas deguonies atomas yra susietas su dviem silicio atomais.
Jennifer Fogaça
Baigė chemiją
Ar norėtumėte paminėti šį tekstą mokykloje ar akademiniame darbe? Pažvelk:
FOGAÇA, Jennifer Rocha Vargas. „Molekulės ir makromolekulės“; Brazilijos mokykla. Yra: https://brasilescola.uol.com.br/quimica/moleculas-macromoleculas.htm. Žiūrėta 2021 m. Birželio 28 d.
Chemija
Kas yra alotropija, paprastos medžiagos, dujų deguonis, ozonas, alotropinės formos, cheminis elementas deguonis, ultravioletiniai saulės spinduliai, deimantas, grafitas, atomiškumas, baltasis fosforas.
Anglies erdvinė formulė, Lewiso elektroninė formulė, plokštumos struktūra, elektroninės poros, ryšys kovalentinis, valentinis sluoksnis, atomo modelio raida, molekulinė formulė, struktūrinė formulė, formulės trimatis.
Cheminės formulės, plokščios struktūrinės formulės, jungties struktūrinė formulė, triguba jungtis, dujos azotas, elektroninė formulė, Lewiso formulė, molekulinė formulė, viengubas ryšys, dvigubas ryšys, dujos anglies.



