Kalorijų kiekis priklauso nuo maisto sudėties. Taigi, norėdami eksperimentiškai nustatyti maisto išskiriamą šilumos kiekį, kurį organizmas gali absorbuoti, naudojame prietaisą, vadinamą kalorimetras.
Šis prietaisas matuoja maistą išskiriančią šilumą, kai jis deginamas. Yra keletas kalorimetrų tipų; pirmasis iš jų 1780 m. buvo sukurtas Lavoisier ir Laplace'o ir buvo a ledo kalorimetras.
Šiuo metu dažniausiai naudojamas ir atsižvelgiama į aukščiau paaiškintą kalorijų sąvoką vandens kalorimetras. Šis prietaisas yra padengtas izoliacine medžiaga, kad būtų išvengta šilumos nuostolių iš terpės; o analizuojamas maistas dedamas į degimo kamera, kuriame yra deguonies dujų ir elektrodai. Šie elektrodai patiria elektros iškrovą ir sukelia jų užsidegimą bei maisto degimą.
Kalorimetre esanti žinoma vandens masė sugeria deginto maisto išskiriamą šilumą ir a termometras matuoja vandens temperatūros padidėjimą. Be to, kalorimetre yra a maišytuvas o tai leidžia vandens temperatūrai visą laiką išlikti vienodai.
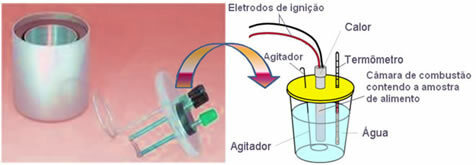
Taigi, jei mes naudojame, pavyzdžiui, 1 gramo cukraus masę, o kalorimetre yra 1000 g vandens, ir mes tai pastebime reakcijos, vandens temperatūra pakilo nuo 20 ° C iki 24 ° C, tai yra, ji padidėjo 4 ° C, tada galime pasiekti cukraus. Kaip? Na, atsižvelgiant į pradinę kalorijų koncepciją, mes turime:
| Pakelkite nuo 1 ° C → 1 cal už gramą vandens |
| Pakelkite nuo 4 ° C → 4 cal už gramą vandens |
Taigi 1 g vandens sugeria 4 kalkes. Tačiau buvo sunaudota 1000 g vandens ir, atsižvelgiant į tai, kad visa degimo metu išsiskirianti šiluma buvo absorbuota, visa vandens absorbuota energija buvo 4000 cal arba 4 kcal. Todėl darome išvadą, kad:
Nesustokite dabar... Po reklamos yra daugiau;)
| Energinė cukraus vertė = 4000 cal / g arba 4 kcal / g. |
Pereinama į SI:
1 kcal 4,18 kJ
4 kcal / g x
x = 16,72 kJ / g
Be to, mes galime naudoti šią lygtį, kad apskaičiuotume atiduotą ar absorbuotą šilumos kiekį:
| Q = m. ç. t |
Kur:
Q = šiluma, kurią atsisako arba sugeria vanduo;
m = vandens masė;
c = savitoji vandens šiluma, lygi 1,0 cal / g. ° C arba 4,18 J / g. ° C;
Δt = vandens patiriamos temperatūros pokytis, kurį lemia galutinės temperatūros sumažėjimas pradine (tf - ti).
Naudodami šią formulę gauname tą patį rezultatą:
Q = m. ç. t
Q = 1000 g. 1,0 kalio / g. ° C. (24-20) ° C
Q = 4000 kal
Q = 4,0 kcal
arba
Q = m. ç. t
Q = 1000 g. 4,18 kJ / g. ° C. (24-20) ° C
Q = 16,72 kJ
Jennifer Fogaça
Baigė chemiją
Ar norėtumėte paminėti šį tekstą mokykloje ar akademiniame darbe? Pažvelk:
FOGAÇA, Jennifer Rocha Vargas. „Maisto kalorijų matavimas naudojant kalorimetrą“; Brazilijos mokykla. Yra: https://brasilescola.uol.com.br/quimica/medindo-as-calorias-dos-alimentos-por-meio-um-calorimetro.htm. Žiūrėta 2021 m. Birželio 27 d.