At tarpmolekulinės jėgos jie yra elektrostatinės traukos jėgos, kurių funkcija yra sujungti molekules (molekulinius junginius), išlaikant jas kietoje ar skystoje būsenoje. Jie yra nepaprastai svarbūs, nes lemia visas fizines savybes (lydymosi temperatūra, virimo temperatūra, tankis ir tirpumas) medžiagų.
Šiame tekste mes ištirsime tarpmolekulinių jėgų ir medžiagų virimo taško santykis. Iš pradžių prisiminkime tris svarbius tarpmolekulinių jėgų tipus:
♦ dipolis dipolis: yra jėga, kuri atsiranda polinėse molekulėse. Kadangi šios molekulės turi teigiamą ir neigiamą polių, dipolio-dipolio jėga yra pagrįsta trauka tarp vienos molekulės teigiamo ir neigiamos kitos galų. Pavyzdžiai: HCl, HBr, SO2 ir PH3
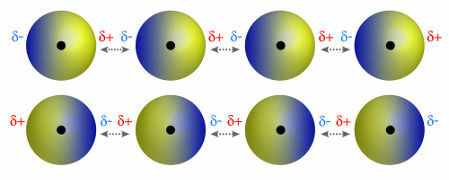
Molekulės, turinčios teigiamą ir neigiamą polių, traukia viena kitą
♦ Sukeltas dipolis: yra tarpmolekulinė jėga, atsirandanti tik nepolinėse molekulėse (jos neturi polių). Artėjant dviem apolinėms molekulėms, įvyksta momentinė jų debesų deformacija elektronai, o tai sukelia disbalansą molekulės elektronuose, kurie pasiskirstę a skirtingi jai. Tuo metu susidaro momentinis dipolis, o molekulė akimirksniu turi teigiamą ir neigiamą polių, kuris sukelia trauką. Pavyzdžiai: CO
2, CH4 ir BH3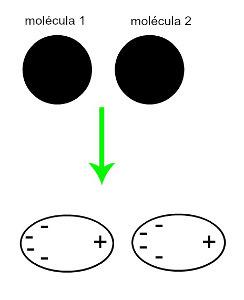
Dviejų nepolinių molekulių artinimas sukuria deformaciją ir atitinkamai elektronų persiskirstymą, kuris sudaro momentinius dipolius
♦ Vandenilio obligacijos: tai tarpmolekulinė jėga, atsirandanti polinėse molekulėse, tačiau tik tose, kurios privalo turėti vandenilio atomus, tiesiogiai sujungtus su fluoro, deguonies ar azoto atomais. Tai galima laikyti dipolio-dipolio jėga, bet kur kas didesnio intensyvumo. Sąveika visada vyksta tarp vienos molekulės vandenilio ir skirtingo kitos molekulės atomo (F, O, N). Pavyzdžiai: H2O, NH3 ir HF
Nesustokite dabar... Po reklamos yra daugiau;)
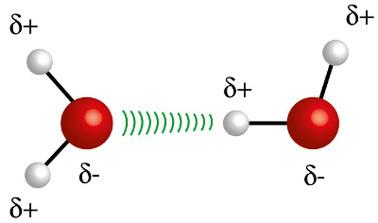
Vienos molekulės vandenilio atomas (baltoji sfera) sąveikauja su kitos vandens molekulės deguonimi (raudona sfera)
Prisiminę tris tarpmolekulines jėgas, dabar galime jas susieti su medžiagų virimo temperatūra. vadinamas virimo taškas temperatūra, kai tam tikros medžiagos molekulės nustoja būti skystoje būsenoje (jų molekulės jėgos nutrūksta) ir pereina į dujinę būseną. Įdomi detalė yra ta, kad tarpmolekulinės jėgos ir virimo temperatūra medžiagų turi labai intensyvų ir tiesioginį ryšį, nes kuo intensyvesnė tarpmolekulinė jėga, tuo aukštesnė virimo temperatūra. Tarpmolekulinių jėgų intensyvumo tvarka yra:
Sukeltas dipolis
Taigi galime daryti išvadą, kad molekulių, turinčių vandenilio ryšius kaip sąveikos jėgą, virimo temperatūros yra aukštesnės nei tose, kuriose yra dipolio-dipolio ir pan. Žemiau esančioje lentelėje pateikiamos trys medžiagos ir jų virimo taško vertės:
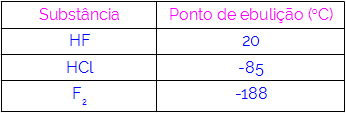
Lentelėje pastebime, kad HF virimo temperatūra yra aukštesnė, nes jo molekulės sujungiamos vandenilio jungtimis. F medžiaga2 jo virimo temperatūra yra žemiausia, nes jo molekules traukia indukuotas dipolis.
Mano. Diogo Lopes Dias
Ar norėtumėte paminėti šį tekstą mokykloje ar akademiniame darbe? Pažvelk:
DIENOS, Diogo Lopes. "Tarpmolekulinės jėgos ir medžiagų virimo temperatūra"; Brazilijos mokykla. Yra: https://brasilescola.uol.com.br/quimica/forcas-intermoleculares-ponto-ebulicao-das-substancias.htm. Žiūrėta 2021 m. Birželio 27 d.
Chemija
Molekulinės medžiagos, virimo temperatūra, kontaktinis paviršius, virimo temperatūra, tarpmolekulinės traukos jėgos, cheminiai ryšiai, molekuliniai junginiai, kovalentiniai cheminiai ryšiai, joninės jungtys, metalinės jungtys, fizikinės būsenos blogai


