Ryšio ir molekulės poliškumas yra susijęs su elektronų pasiskirstymu aplink atomus.Jei šis pasiskirstymas yra simetriškas, molekulė bus nepolinė, bet jei ji bus asimetriška, o viena iš molekulės dalių turi didesnį elektronų tankį, taigi tai yra polinė molekulė.
Molekulių poliškumą galima vizualizuoti, kai jų sudedamoji medžiaga yra veikiama išorinio elektrinio lauko. Jei molekulės orientuojasi esant šiame lauke, tai yra, jei vieną dalį pritraukia teigiamas polius, o kitą molekulės - neigiamas, tada jie yra poliniai. Priešingu atveju jei jie nesiorientuoja, jie yra nepoliniai.
Pavyzdžiui, kai flaneliu labai trinate stiklinę lazdelę, ji tampa teigiamai įkrauta. Jei priartėsime prie vandens srauto, krentančio iš maišytuvo, pamatysime, kad vanduo ir toliau nenukris tiesia vertikalia trajektorija, bet trauks lazda, nukentėjęs nuo nukrypimo. Tai rodo, kad vanduo yra poliarinis. Bet jei atliksime tą patį eksperimentą su aliejaus filė, jis nenukryps savo trajektorija, parodydamas, kad jo molekulės yra nepolinės.
Analizuodami molekulių struktūrą, galime nustatyti, ar jos yra polinės, ar ne, atsižvelgdami į du svarbius veiksnius: elektronegatyvumo skirtumas tarp atomų ir molekulės geometrijos.
1) Atomų elektronegatyvumas:
Jei molekulę sudaro ryšiai tarp tų pačių cheminių elementų atomų, tai yra, jei tai yra paprastos medžiagos, tokios kaip O2, H2, ne2, Cℓ2, P4, S8ir kt., jie bus nepoliniai, nes tarp jų atomų nėra elektronegatyvumo skirtumų.
Vienintelė išimtis yra ozono molekulė (O3), kuris bus matomas vėliau.
Jei molekulė yra diatominė ir suformuota skirtingų elektronegatyvumų elementų, tai molekulė bus polinė. Pavyzdžiai: HCℓ, HF, HBr ir HI.
2) Molekulių geometrija:
Molekulės geometrija daro įtaką elektronų pasiskirstymui joje, taigi ir jos poliškumui. Jei molekulę sudaro trys ar daugiau atomų, turėsime išanalizuoti kiekvieną susidariusį ryšį ir molekulės geometriją. Žr. Pavyzdį: CO2 - linijinė molekulė:
δ- δ+ δ-
O = C = O
Atkreipkite dėmesį, kad deguonis yra labiau neigiamas nei anglis, todėl jungiamuosius elektronus labiau traukia deguonis. Jose susidaro dalinis neigiamas krūvis (δ-), tuo tarpu anglyje susidaro dalinis teigiamas krūvis (δ+). Vadinamas atstumo tarp atomų branduolių, sujungtų su šiais krūviais, padauginimas iš modulio (tai yra tik skaičius be pliuso ar minuso ženklo). dipolio momentas ir atstovaujama μ.
μ = d. |δ|
Šį dipolio momentą rodo rodyklės, nukreiptos į labiausiai elektronegatyvaus elemento, kuris pritraukia elektronus, kryptį: O ← C → O. Tai rodo, kad šis dydis yra vektorius (dydis, kurio dydis ar intensyvumas, kryptis ir kryptis). Todėl jį geriausiai vaizduoja:  .
.

Susumavus visus vektorius, randame gautą dipolio momentą, 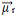 , kuris šiuo atveju buvo lygus nuliui, nes du dipolio momentai turi vienodas vertes, tačiau eina priešingomis kryptimis, panaikindami vienas kitą.
, kuris šiuo atveju buvo lygus nuliui, nes du dipolio momentai turi vienodas vertes, tačiau eina priešingomis kryptimis, panaikindami vienas kitą.
Kai gautas dipolio momento vektorius yra lygus nuliui, molekulė yra nepolinė, bet jei ji yra nulis, ji bus polinė.
Todėl CO molekulės atveju2, ji yra apolari.
Dabar pažvelk į kitą pavyzdį: H2O - kampinė geometrija (nes deguonyje yra dvi elektronų poros, esančios atokiausiame lygyje, kurios atstumia elektronus nuo jungčių su vandeniliais):
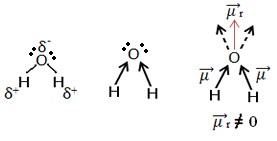
Elektronus traukia deguonis. Bet šiuo atveju vektoriai neatšaukia vienas kito, nes vandens molekulinė geometrija yra kampinė, nes jos kryptys nėra priešingi, suteikiant nulinės vertės dipolio momento vektorių, todėl vandens molekulė yra poliarinis.
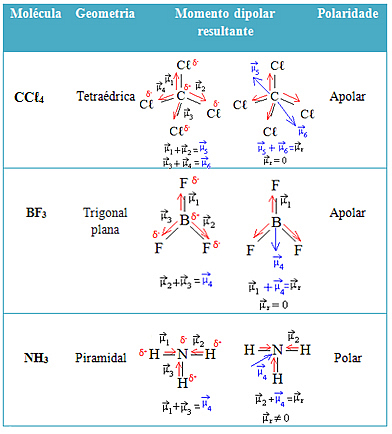
Daugiau pavyzdžių rasite toliau pateiktoje lentelėje:
Jennifer Fogaça
Baigė chemiją
Šaltinis: Brazilijos mokykla - https://brasilescola.uol.com.br/quimica/polaridade-das-moleculas.htm