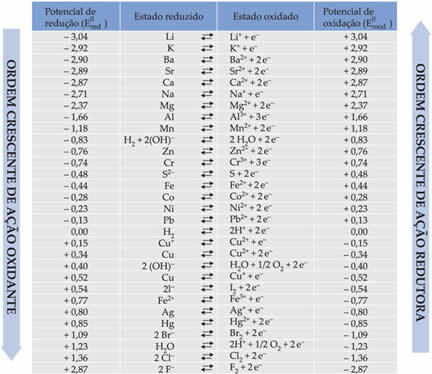
Baterija tai sistema, kurioje cheminė energija savaime virsta elektros energija.
1836 m. Anglų chemikas ir meteorologas Johnas Fredericas Daniellas (1790–1845) pastatė kitokią nei tuo metu žinomą krūvą: Alessandro Volta krūvą. Šioje krūvoje jis sujungti du elektrodai, kurie buvo sistemos, susidedančios iš metalo, panardinto į druskos vandeninį tirpalą, susidariusį šio metalo katijonuose.
Vieną iš elektrodų, vario elektrodą, sudarė vario plokštė, panardinta vario sulfato tirpale (CuSO4). Kitas elektrodas buvo cinko elektrodas, susidedantis iš cinko plokštės, panardintos į cinko sulfato (ZnSO4) tirpalą.
Šie du elektrodai buvo sujungti elektros grandine, kurioje buvo lempa, nes jei ji įsijungtų, tai rodytų elektros srovės atsiradimą.
Be to, tarp jų buvo druskos tiltas. Šį tiltą sudarė U formos stiklo vamzdelis, kuriame buvo koncentruotas vandeninis tirpaus druskos tirpalas, pavyzdžiui, kalio chloridas (KCl (aq)). Vamzdžio galai yra padengti medvilne arba agaru.
Žemiau pateikiama šios ląstelės arba elektrocheminės ląstelės struktūra, kuri tapo žinoma kaip Danielio ląstelė. Prisimindami, kad kiekvienas elektrodas vadinamas puselementiu.
Uždarius grandinę, lempa įsijungia ir po kurio laiko cinko plokštė yra korozija ir jos masė sumažėjo, o vario plokštė yra priešinga, jos masė didėja (kaip parodyta paveikslėlyje žemiau). Taip pat pažymima, kad padidėja Zn jonų koncentracija mol / L2+ o Cu jonų sumažėjimas2+.
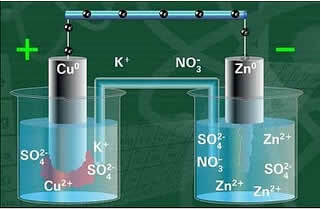
Daniello „Stack Schema“.
Kodėl tai vyksta?
Nesustokite dabar... Po reklamos yra daugiau;)
Norėdami suprasti, pažvelkime į reakcijas, kurios vyksta prie kiekvieno elektrodo atskirai.
Cinko elektrode įvyksta tokia pusiausvyros reakcija:
Zn (s) ↔ Zn2+(čia) + 2 ir-
Tai reiškia, kad metalinis cinkas (iš plokštelės) oksiduojasi, tai yra, duoda du elektronus cinko katijonui (iš tirpalo) ir tampa Zn2 +. Taip pat vyksta priešingai, tirpale esantis cinko katijonas priima du cinko paaukotus elektronus ir tampa metaliniu cinku. Todėl vyksta nenutrūkstamas oksidacijos ir redukcijos procesas.
Tas pats pasakytina apie vario elektrodą, kurio dinaminė pusiausvyra turės visuotinę reakciją: Cu (s) ↔ Cu2+(čia) + 2 ir-
Daniell suprato, kad jei jis sujungtų šiuos du elektrodus, reaktyvesnis žmogus paaukotų savo elektronus mažiau reaktyviems katijonams, užuot tai daręs su katijonais savo sprendime. Šiuo atveju cinkas yra pats reaktyviausias ir oksiduojamas, paaukodamas elektronus variui, taigi sumažėja jo masė. Oksiduojamas elektrodas yra neigiamas polius, vadinamas anodu. Vario elektrodas yra redukuojamas, vario katijonas gauna du elektronus iš cinko ir vadinamas katodu (teigiamuoju poliu).
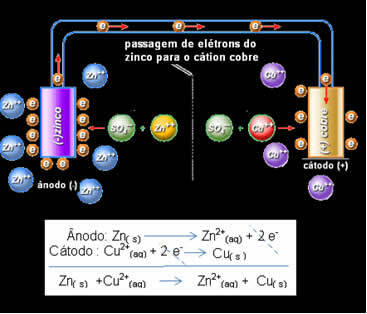
Elektronų ištrauka ir Daniello kamino visuotinė lygtis.
Aukščiau mes turime šio kamino visuotinę lygtį, kuri gaunama pridedant dvi pusės reakcijas. Jo atvaizdavimas arba cheminis žymėjimas atliekamas pagal šią taisyklę:

Taigi, Daniell'o stekui turime:
Zn / Zn2+// Asilas2+ / asilas
Jennifer Fogaça
Baigė chemiją
Brazilijos mokyklos komanda
Fizikocheminis - Chemija - Brazilijos mokykla
Ar norėtumėte paminėti šį tekstą mokykloje ar akademiniame darbe? Pažvelk:
FOGAÇA, Jennifer Rocha Vargas. „Danilo krūva“; Brazilijos mokykla. Yra: https://brasilescola.uol.com.br/quimica/pilha-daniell.htm. Žiūrėta 2021 m. Birželio 28 d.