Jei akumuliatoriuje naudosime voltmetrą, galėsime nustatyti potencialo (U arba ddp) arba elektromotorinės jėgos (emf arba E) skirtumą tarp dviejų elektrodų. Tačiau tokiu būdu neįmanoma nustatyti kiekvieno elektrodo redukcijos ar oksidacijos potencialų.
Mokslininkams reikėjo žinoti šias vertes, norint ištirti oksidacijos-redukcijos procesus, todėl jie nustatė a atskaitos būsena. Tai reiškia, kad buvo sutarta išmatuoti kiekvieno elektrodo potencialą kito elektrodo atžvilgiu šiomis standartinėmis sąlygomis:
• temperatūra turi būti 25 ° C;
• Slėgis esant 1,0 atm;
• Tirpalo, kuriame panardinamas metalas, koncentracija turi būti 1,0 mol / L.
Taigi pasirinktas elektrodas buvo vandenilio elektrodas, kuris yra pateiktas žemiau:
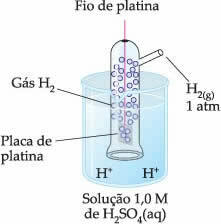
Šis elektrodas susideda iš platinos vielos, sujungtos su platinos plokštele, kuri nedalyvauja reakcijoje, vamzdžio, kuriame yra vandenilio dujų, viduje ir panardintame į rūgštinį tirpalą. Pavyzdyje tirpalas buvo sieros rūgštis.
| Pagal susitarimą vertė buvo priskirta standartiniam vandenilio elektrodui nulis, tiek apie E0raudona kaip dėl E0oxy. |
Taigi, norėdami rasti bet kurio kito elektrodo potencialią vertę, mes tiesiog pastatome norimo elektrodo šūsnį standartiniu vandenilio elektrodu ir išmatuojame ddp voltmetru. Voltmetre rodoma vertė bus ieškomo elektrodo potencialas, nes vandenilio vertė lygi nuliui.
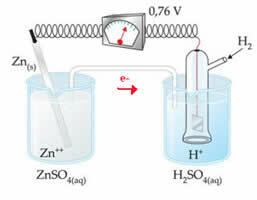
Pavyzdžiui, mes sujungiame cinko elektrodą su vandenilio elektrodu, kad sužinotume, koks yra jo redukcijos potencialas:
Nesustokite dabar... Po reklamos yra daugiau;)
Pagal pirmiau pateiktą schemą voltmetras nustatė, kad potencialų skirtumas yra lygus +0,76 (? E0 = +0,76). Mes taip pat pažymime, kad cinko elektrodas oksidavosi, taigi jis yra anodas; ir vandenilio elektrodas redukuotas, kuris yra katodas.
Taigi mes turime:
? E0 = E0red (katodas) - E0 raudonas (anodas)
0,76 = 0,00 - E0 raudona (Zn)
E0 raudona (Zn) = 0,00-0,76
E0 raudona (Zn) = -0,76
Neigiama reikšmė reiškia, kad elektronų srovė teka iš cinko elektrodo (anodo) į vandenilio elektrodą, taigi elgiasi kaip katodas. Jei tai būtų teigiama, būtų atvirkščiai, o vandenilio elektrodas elgtųsi kaip anodas. Tai galima pamatyti, kai varinį elektrodą sujungiame su standartiniu vandenilio elektrodu:
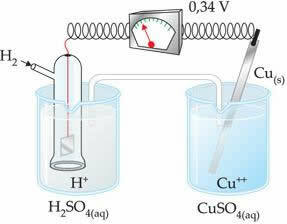
? E0 = E0red (katodas) - E0 raudonas (anodas)
-0,34 = 0,00 - E0 raudona (Zn)
E0 raudona (Zn) = 0,00 + 0,34
E0 raudona (Zn) = +0,34
Taigi galima apibrėžti įvairiausių cheminių rūšių redukcijos ir oksidacijos potencialą. Tačiau Tarptautinė grynosios ir taikomosios chemijos sąjunga (IUPAC) rekomenduoja naudoti tik redukcijos potencialą. Nepaisant naudojamo metalo, vaizduojant akumuliatorių, vandenilio elektrodas visada yra pirmas, pavyzdžiui:
Pt - H2 (g) 1atm / H3O1 + (aq) 1 mol / L // Cu2 + (aq) 1 mol / L / Cu
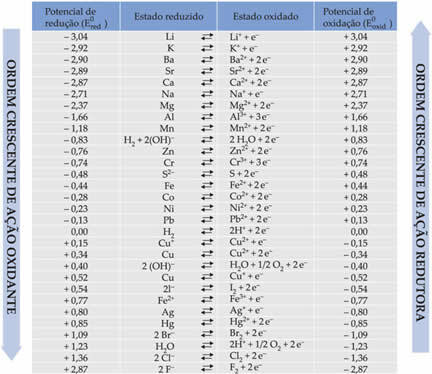
Žemiau lentelėje išvardyti potencialai, pasiekti naudojant šį standartinio vandenilio elektrodo naudojimo metodą, kartu su jų atitinkamomis pusiau reakcijomis:
Jennifer Fogaça
Baigė chemiją
Brazilijos mokyklos komanda
Ar norėtumėte paminėti šį tekstą mokykloje ar akademiniame darbe? Pažvelk:
FOGAÇA, Jennifer Rocha Vargas. „Elektrocheminių galimybių matavimas“; Brazilijos mokykla. Yra: https://brasilescola.uol.com.br/quimica/medicao-dos-potenciais-eletroquimicos.htm. Žiūrėta 2021 m. Birželio 28 d.

