Specifinė šiluma yra fizikos ištirtas kiekis, susiejantis medžiagos gaunamą šilumos kiekį ir jos šiluminius pokyčius.
Taip pat vadinama šiluminė talpa, šis dydis rodo šilumos kiekį, kurio reikia, kad gramas bet kurios medžiagos pasikeistų temperatūra atitinka 1 ° C, be to, nurodoma medžiagos elgsena veikiant šilumos šaltiniui.
Specifinė šiluma yra tiesiogiai susijusi su vadinama fizikos sritimi Kalorimetrija, kuris tiria energijos perdavimą iš aukštesnės temperatūros kūno į kitą žemesnės temperatūros kūną.
Šiame tyrime specifinė šiluma yra apibrėžta protinga šiluma ir šiluminė talpa medžiaga, nes kai kuriuos reiškinius galima geriau suprasti iš šilumos apibrėžimo specifinis.
Kuo didesnė specifinė šiluma, tuo didesnis šilumos kiekis turi būti tiekiamas arba pašalinamas iš medžiagos, kad ji turėtų šiluminę variaciją.
Pavyzdžiui, vanduo, lyginant su kitomis medžiagomis, turi didžiausią savitąją šilumą, atitinkančią 1 cal / g.ºC.
Konkrečių šilumos verčių palyginimo lentelė
Kitos medžiagos ir medžiagos taip pat turi savo specifines šilumos vertes, kaip parodyta toliau pateiktoje lentelėje:
| Medžiaga | Savitoji šiluma (cal / g.ºC) |
| Vanduo | 1 cal / g. ° C |
| Etilo alkoholis | 0,58 cal / g. ° C |
| Aliuminis | 0,22 cal / g. ° C |
| Oro | 0,24 cal / g. ° C |
| Smėlis | 0,2 cal / g. ° C |
| Anglis | 0,12 cal / g. ° C |
| Vadovauti | 0,03 cal / g. ° C |
| Varis | 0,09 cal / g. ° C |
| Geležis | 0,11 cal / g. ° C |
| Ledas | 0,50 cal / g. ° C |
| Vandenilis | 3,4 cal / g. ° C |
| mediena | 0,42 cal / g. ° C |
| Azotas | 0,25 cal / g. ° C |
| Deguonis | 0,22 cal / g. ° C |
| Stiklas | 0,16 cal / g. ° C |
Specifinė šilumos formulė
Norint žinoti specifinę medžiagų šilumą, reikia naudoti šią formulę:
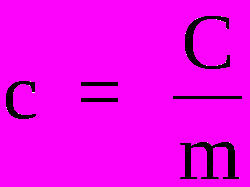
Kur,
ç - savitoji šiluma (cal / g ° C arba J / Kg. K)
Ç - šiluminė talpa (cal / ° C arba J / K)
m - masė (g arba kg)
Tarptautinėje sistemoje (SI) savita šiluma matuojama J / kg. K (džaulis kilogramui ir kelvinui). Tačiau dažniausiai naudojamas matas yra kal / g ° C (kalorijų kiekis grame ir Celsijaus laipsnyje).
Taip pat žr šilumos ir temperatūra.
