Metalai yra elementai, kuriems būdingas ryškumas, stiprumas, šilumos ir elektros laidumas. Jie yra taikoma praktiškai visuose pramoniniuose procesuose, metalų lydiniuose, naudojamuose įrankių, papuošalų ir monetų gamybai, ir cheminiuose procesuose, tokiuose kaip redoksas, atsakingi už kaminai ir baterijos.
Periodinėje lentelėje jie skirstomi į:
semimetalai
pereinamieji metalai
šarminiai metalai
šarminių žemių metalai
Plieno pramonėje jie skirstomi į:
juodieji metalai
spalvotieji metalai
sunkieji metalai
Taip pat skaitykite: Kokie yra nauji periodinės lentelės elementai?
Metalo charakteristikos

Jie dažniausiai yra puikūs šilumos ir elektros energijos laidininkai.
Jie turi blizgančią išvaizdą.
turi aukštą tankis.
Jie yra elektropozityvūs elementai (jie linkę formuoti katijonus - teigiamus krūvius).
Išskyrus Merkurijus, jie yra aukštos lydymosi temperatūros elementai ir kieti kambario temperatūroje.
Jie turi mechaninį stiprumą (atsparumą).
Jie yra kaliojo (gali būti formuojami nesulaužant).
Nesustokite dabar... Po reklamos yra daugiau;)
Periodinės lentelės metalai
šarminiai metalai
Ar yra elementai pirmasis periodinės lentelės stulpelis, 1A šeima. Jie vadinami šarminiais metalais, nes, sumaišyti su vandeniu, susidaro hidroksidai, tai yra šarminis (bazinis) tirpalas.
Tu elementai priklausantys šiai grupei yra:
Ličio li)
Natris (At)
Kalis (K)
Rubidiumas (Rb)
Cezis (Cs)
Frankis (fr)
Pateikiama tik elektroninė šarminių metalų konfigūracija neutralioje būsenoje (nepakrauta / jonizuota) elektronas paskutiniame apvalkale (valentinis sluoksnis). O atominis spindulys ir šių metalų reaktyvumas didėja iš viršaus į apačią (stebint Periodinė elementų lentelė). Jie turi žemą lydymosi temperatūrą, palyginti su kitais metalais, yra kaliojo ir nėra labai tankūs, turi matinį didelis oksidacijos potencialas.
Taip pat žiūrėkite:Kokios yra materijos savybės?
šarminių žemių metalai
Tai yra elementai, kurie rodomi antras periodinės lentelės stulpelis, 2A šeima. yra vadinami šarminė žemė dėl polinkio formuoti pagrindinio (šarminio) pobūdžio ir žemiškus tirpalus, nes iki XIX a. šių medžiagų sudaryti oksidai buvo pažymėti tokiu būdu. Šis terminas buvo naudojamas netirpiems metalams žymėti, kurie kaitinant nepatyrė mutacijos, bendros 2 grupės elementų savybės. Vėliau, atsižvelgiant į naujus tyrimus ir eksperimentus, buvo atrasta, kad „žemės“ elementai iš tikrųjų buvo metalų sudaryti oksidai.
Jie yra kaliojo metalo, turintys mažą tankį du elektronai jo tolimiausiame apvalkale, esant normalioms temperatūros ir slėgio sąlygoms, yra kietos būsenos. Priklauso šiai grupei:
Berilis (Būti)
Magnis (Mg)
Kalcis (Čia)
Stroncis (p.)
Bariumas (Ba)
Radijas (Varlė)
pereinamieji metalai
sudaro periodinės lentelės B grupėir yra tarp šarminių žemių metalų ir ametals. IUPAC juos apibrėžė kaip elementus, turinčius neišsamų energéticad'o energetinį posluoksnį. Terminas "pereinamieji metalai"reiškia perėjimas iš 2 grupės į 13 periodinėje lentelėje ir vis didėjantis elektronų kiekis „d“ orbitoje.
Pereinamojo metalo grupė susideda iš tankių elementų, turinčių aukštą lydymosi ir virimo temperatūrą, ir mažiau reaktyvūs nei 1 ir 2 grupės metalai (1A ir 2A šeima). Tarp pereinamųjų metalų yra volframas, kuris yra aukščiausia lydymosi temperatūra (3422 ° C), ir gyvsidabris (Hg), kuris yra metalas, skystas normaliomis temperatūros ir slėgio sąlygomis, jo lydymosi temperatūra yra (-38,83 ° C).
Pereinamieji metalai turi įvairias oksidacijos būsenas (NOX kintamasis) ir sudaro spalvotas medžiagas.

Vidiniai perėjimo elementai
Vidiniai perėjimo elementai jie yra:
Lantanidai: serijos, sudarytos iš elementų, turinčių 57–71 protonus ir kurie, išskyrus prometį, yra natūralūs.
Aktinidai: grupė, sudaryta iš elementų, kurių atominis skaičius svyruoja nuo 89 iki 103 ir kurie dažniausiai yra sintetiniai. Visa ši grupė yra radioaktyvus su trumpu pusinės eliminacijos periodu.
Šių dviejų grupių elementai turi aukštą lydymosi temperatūrą ir visi yra kieti kambario temperatūroje.
Pusiau metalai
Tu semimetalai iš viso yra septyni elementai:
Boras (B)
Silicis (Si)
Germanis (ge)
Arsenas (As)
Stibis (Pirmadienis)
Tellūras (Te)
Polonis (Po)
Ši klasifikacija suteikiama elementams, kurie turi fizikinės ir cheminės charakteristikos, susijusios su metalais, taip pat kitos, susijusios su nemetaliniais elementais. Semimetalai turi blizgesį, yra trapūs junginiai, galintys formuoti katijonus ir anijonus (priklausomai nuo būklės) ir yra tarpiniai laidininkai.
Metalų rūšys
Geležies: medžiagos, kurių sudėtyje yra geležies. Jie yra metalo lydiniai kuriuose geležis yra bendras elementas, tačiau jas galima suformuluoti skirtingomis koncentracijomis anglies, pavyzdžiui, arba suklastoti naudojant skirtingas technologijas, taip turint skirtingų fizinių savybių produktus.
Spalvotieji: lydiniai, kuriuos sudaro kitų tipų metalai, pvz aliuminis, vario, nikelio, cinkas, titanas.
Sunkieji metalai: švinas, nikelis, cinkas, gyvsidabris. Jie yra reaktyvūs, toksiški ir bioakumuliaciniai metalai. Jie, be kita ko, naudojami baterijose, lempose, šaudmenyse karo artefaktams.
Cheminiai metalų ryšiai
Metalai yra elementai elektropozityvus, tai yra, jie turi polinkį prarasti elektronus cheminėje jungtyje. Kai metalas sąveikauja su nemetalu, jis atlikti joninį ryšį dėl skirtumo elektronegatyvumas. Kita metalų sujungimo galimybė yra metalų jungtys.
At metalinės jungtys atsiranda tarp metalų, dalinai išsiskiriant elektronams ir susidarant elektronų debesiui ar jūrai aplink atomus, o tai garantuoja metalinėms dalims laidumas elektrinis ir plastinis.
Taip pat žiūrėkite: Laidininkai ir izoliatoriai - kokie yra skirtumai?
Metalų gavimas
Dauguma metalų yra natūraliai uolienos ir mineralai, susiję su kitais elementais. Yra keletas metalų rafinavimo būdų, pavyzdžiui, naudojant elektrolizę ir chemines reakcijas į atskirus junginius.
Metalų atveju du pramoniniu mastu dažniausiai naudojami būdai tam tikram metalo grynumo laipsniui gauti yra šie: skirtumas tankis ir magnetinis imlumas (polinkis, kad metalas turi reaguoti į a magnetinis laukas).

sprendė pratimus
Klausimas 1 - (Enem) Baterijose esantis kadmis gali patekti į žemę, kai šios medžiagos netaisyklingai pašalinamos į aplinką arba kai jos sudeginamos. Skirtingai nuo metalinės formos, Cd2 + jonai yra labai pavojingi organizmui, nes gali pakeisti Ca2 + jonai sukelia kaulų degeneracinę ligą, todėl jie yra labai akyti ir sukelia stiprų kaulų skausmą. sąnariai. Jie taip pat gali slopinti Zn2 + katijonu aktyvuojamus fermentus, kurie yra ypač svarbūs inkstų veiklai. Paveikslėlyje parodyta kai kurių metalų ir jų katijonų spindulio kitimas.
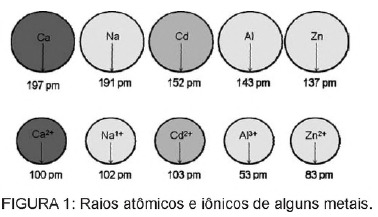
Remiantis tekstu, jo joninės formos kadmio toksiškumas yra šio elemento pasekmė
A) yra maža jonizacijos energija, kuri skatina jonų susidarymą ir palengvina jo prisijungimą prie kitų junginių.
B) turi polinkį veikti biologiniuose procesuose, tarpininkaujant metaliniams katijonams, kurių krūvis svyruoja nuo +1 iki +3.
C) turi spindulį ir krūvį palyginti arti metalo jonų, veikiančių biologinius procesus, sukeldami šių procesų trukdžius.
D) turi didelį joninį spindulį, leidžiantį kištis į biologinius procesus, kuriuose paprastai dalyvauja mažesni jonai.
E) turi +2 krūvį, kuris leidžia jam trukdyti biologiniams procesams, kuriuose paprastai dalyvauja žemesnio krūvio jonai.
Rezoliucija
C alternatyva. Kadmis yra elementas, panašus į metalinius jonus, kuriuos natūraliai turime kūne. Be to, kadmis yra bioakumuliacinis, jis panašus į metalines grupes, gali prisijungti prie sulfhidrilo molekulių grupių baltymų, taip sukeldami biologinių procesų pokyčius, tokius kaip nukalkėjimas, audinių ir raudonųjų kraujo kūnelių sunaikinimas kraujas.
2 klausimas - Norėdami pažymėti metalams svarbias charakteristikas, pažymėkite netinkamą alternatyvą.
A) Dauguma metalų yra geri elektros ir šilumos laidininkai.
B) Kai kurie metalai yra jautrūs oksidacijai ir (arba) redukcijai.
C) Geležis yra atsparus ir kalus metalas, tai yra, jis lengvai formuojamas.
D) Šarminių žemių metalai turi šį pavadinimą „žemė“, nurodydami šių metalų oksidus, kurie yra tamsios spalvos.
E) Metalai yra įvairių spalvų ir nuobodu elementai dėl oksidacijos.
Rezoliucija
E alternatyva. Metalai yra natūraliai blizgūs ir metalinės spalvos, jie gali oksiduotis, dėl to pasikeičia metalui būdingos savybės dalies aspektą, tačiau tai nėra reiškinys, pasitaikantis visuose metaluose, o kai kuriais atvejais oksidacija priklauso nuo kelių veiksnių išorinis.
pateikė Laysa Bernardes
Chemijos mokytoja