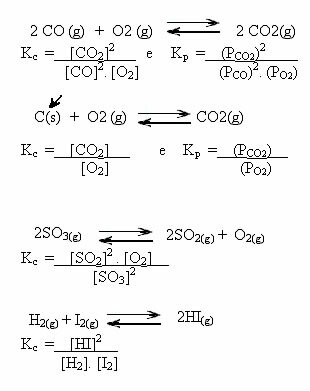
Daugumoje cheminių reakcijų, kurios praktiškai vykdomos pramonėje ir laboratorijose, gauto produkto kiekis yra mažesnis už teoriškai numatomą kiekį. Tai reiškia, kad reakcijos išeiga nėra lygi 100%, nes bendra reagentų masė nebuvo visiškai paversta produktais.
Tai gali atsitikti dėl kelių veiksnių, žiūrėkite dažniausiai:
- Gali atsirasti lygiagrečios reakcijos į norimą reakciją ir dėl to sunaudojama dalis vieno ar abiejų reagentų, susidarant nepageidaujamiems produktams;
- Reakcija gali būti neišsami, nes ji yra grįžtama; taigi dalis susidariusio produkto vėl virsta reagentais;
- Produkto nuostoliai gali atsirasti reakcijos metu, pavyzdžiui, naudojant prastos kokybės prietaisus arba dėl operatoriaus klaidos.
Taigi labai svarbu žinoti realios pajamos arba reakcijos išeiga to galima tikėtis tomis sąlygomis, kuriomis vyksta reakcija. Reakcijos išeiga yra a teoriškai tikėtino procento. Norėdami tai padaryti, turime atlikti tris toliau išvardytus veiksmus:

Žr. Keletą pavyzdžių, kaip atliekamas tokio tipo skaičiavimas:
1-as pavyzdys: 2 g vandenilio dujų (H2) su 16 g deguonies dujų (O2), gaunant 14,4 g vandens (H2O). Apskaičiuokite faktinį šios reakcijos rezultatą. (Duomenys: Molinės masės: H2 = 2 g / mol; O2 = 32 g / mol; H2O = 18 g / mol).
1-as žingsnis:
Turime parašyti cheminę reakciją subalansuotas žinoti, koks yra teorinis šios reakcijos rezultatas:
2 valandos2 + 1 O2 → 2 H2O
2 mol 1 mol 2 mol
↓ ↓ ↓
2. 2g 1. 32g 2. 18 g
4g 32g 36g
Teoriškai 4 g H2 reagavo su 32 g O2, susidaro 36 g H2O. Naudodami pratime pateiktas reikšmes, mes sudarome paprastą trijų taisyklę ir randame teorinį derlių. Tai bus padaryta kitame etape.
2 žingsnis:
Svarbu patikrinti, ar kuris nors iš reagentų riboja reakciją, nes jei ji pasibaigs, reakcija sustos, neatsižvelgiant į tai, kiek vis dar turite kito reagento perteklių. Norėdami tai sužinoti, tiesiog nustatykite produkto kiekį, kurį susidarytų kiekvienas reagentas atskirai:
- Į H2: - Į O2:
4 g H2 36 g H232 g H2 36 g H2O
2 g H2 x 16 g H2 x
Nesustokite dabar... Po reklamos yra daugiau;)
x = 2 g. 36 g = 18 g vandens x = 16 g. 36 g = 18 g vandens
4g 32g
Kadangi tai davė tą patį pagaminto vandens kiekį, jie reaguoja proporcingai ir nėra nei reagento pertekliaus, nei ribojančio reagento.
3 žingsnis:
Dabar tiesiog susiekite teorinį išeigą (18 g vandens) su faktiniu reakcijos metu gautu išeiga, kuri buvo nurodyta teiginyje (14 g vandens):
Teorinis derlius 100%
realios pajamos x
x = Faktinės pajamos. 100%
Teorinis derlius
18 g 100% vandens
14,4 g vandens x
x = 14,4 g. 100%
18g
x = 80%
Šios reakcijos išeiga buvo lygi 80%.
Bet kas būtų, jei žinotume, koks procentinis derlius ir norėtume sužinoti reakcijos metu gauto produkto masės kiekį? Kitas pavyzdys yra apie tai:
2-as pavyzdys: Amoniako (NH) gamybos reakcijoje3), 360 g vandenilio dujų (H2) ir pakankamas azoto dujų kiekis (N2), gaunant 20% derlių. Kokia buvo amoniako masė? (Duomenys: Molinės masės: H2 = 2 g / mol; N2 = 28 g / mol; NH3 = 17 g / mol).
1-as žingsnis:
1 N2 + 3 H2 → 2 NH3
1 mol 3 mol 2 mol
↓ ↓ ↓
1. 28 g 3. 2 g 2. 17 g
28 g 6 g 34 g
Paimkime tik vandenilio dujas, kurių masė, panaudota reakcijoje, buvo pateikta vykdant:
2 žingsnis:
Kadangi pasakymas pasakė, kad jis buvo naudojamas „Pakankamas azoto dujų (N2)”, mes jau žinome, kad nėra jokio reagento pertekliaus.
Paimkime tik vandenilio dujas, kurių masė, panaudota reakcijoje, buvo pateikta vykdant:
6 g H2 34 g NH3
360 g H2 x
x = 360 g. 34 g = 2040 g NH3
6 g
3 žingsnis:
Teorinis derlius 100%
x Procentinis derlius
2040 g NH3 100%
x g NH3 20%
x = 2040 g. 20%
100%
x = 408 g NH3
Reakcijoje 360g vandenilio dujų, gaunant 20% išeiga, gaunama 408g amoniako dujų.
Jennifer Fogaça
Baigė chemiją
Ar norėtumėte paminėti šį tekstą mokykloje ar akademiniame darbe? Pažvelk:
FOGAÇA, Jennifer Rocha Vargas. „Reakcijos išeiga“; Brazilijos mokykla. Yra: https://brasilescola.uol.com.br/quimica/rendimento-uma-reacao.htm. Žiūrėta 2021 m. Birželio 27 d.