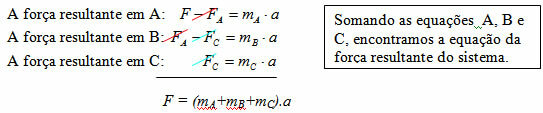Dujos ir garai
Skirtumas tarp dujų ir garų nurodomas pagal kritinę temperatūrą. Garai yra dujinės būsenos materija, būsena, kurią galima suskystinti didėjant slėgiui. Dujos nėra vienodos. Tai yra skystis, kurio negalima suskystinti paprasčiausiai padidinus slėgį. Dėl to dujos skiriasi nuo garų.
Dujų elgesys
Tam tikra dujinės būsenos medžiaga yra dujos, jei jų temperatūra yra aukštesnė už kritinę temperatūrą, jei temperatūra yra lygi arba žemesnė už kritinę temperatūrą, kurioje medžiaga yra garai.
Tikrosios dujos, kurias paprastai žinome, pvz., Helis, azotas ir deguonis, turi skirtingas kiekvienos molekulines savybes. Tačiau jei juos visus laikysime aukštoje temperatūroje ir žemame slėgyje, jie imsis labai panašaus elgesio. Tiriant dujas, naudojamas paprastas teorinis modelis, kurio praktiškai nėra, o jo elgesys panašus į realių dujų. Šis priartinimas gerėja, tuo žemesnis slėgis ir aukštesnė temperatūra. Šis dujų modelis vadinamas tobulos dujos.
Maždaug XVII ir XIX amžiuje trys mokslininkai (Jacques Charles, Louis J. Gay-Lussac ir Paulas E. Clayperon), ištyręs dujų elgseną, sukūrė įstatymus, reglamentuojančius tobulų dujų, dar vadinamų idealiomis dujomis, elgseną. Jų nustatytais dėsniais nustatomos tobulų dujų „išorinio“ elgesio taisyklės, vedančios jis skaičiuoja tik su jais susijusius fizinius dydžius, kurie yra: tūris, temperatūra ir spaudimas.
Bendras tobulų dujų dėsnis
Išraiška, nulemianti bendrą tobulų dujų dėsnį, gali būti matoma taip:
Nesustokite dabar... Po reklamos yra daugiau;)
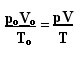
kur pO, VO ir tO yra atitinkamai pradinis slėgis, pradinis tūris ir pradinė temperatūra. Tai yra išraiška, naudojama, kai skiriasi dujų kintamieji.
Boyle'io įstatymas
Robertas Boyle'as, fizikas ir chemikas, buvo tas, kuris nustatė dėsnius, kurie reguliuoja transformacijas, vykstančias dujomis, kai jų temperatūra yra pastovi. Jo įstatymas sako, kad kai dujos izotermiškai transformuojasi, jų slėgis yra atvirkščiai proporcingas užimamam tūriui. Iš šio dėsnio mes gauname, kaip TO = T. Mes privalome:
POVO = pV
Karolio įstatymas
Karolio įstatymas yra įstatymas, reguliuojantis tobulų dujų transformacijas į pastovų tūrį. Šios transformacijos vadinamos izohorinėmis arba izometrinėmis transformacijomis. Pagal šį dėsnį, kai tobula dujų masė patiria izochorinę transformaciją, jos slėgis yra tiesiogiai proporcingas absoliučiai temperatūrai. Matematiškai šį dėsnį galima išreikšti taip:

kur pO ir tO yra atitinkamai pradinis slėgis ir pradinė temperatūra.
Gėjaus-Lusako įstatymas
Gay-Lussac įstatymas yra įstatymas, valdantis tobulų dujų transformacijas esant nuolatiniam slėgiui. Šį įstatymą, nepaisant Gay-Lussac pavadinimo, jau atrado fizikas ir chemikas A. C. Charlesas. Pagal įstatymą, kai dujos patiria izobarinę transformaciją, dujų tūris yra tiesiogiai proporcingas jų absoliučiai temperatūrai. Matematiškai šį dėsnį galima išreikšti taip:

Kur VO ir tO atitinka pradinį tūrį ir pradinę temperatūrą.
Autorius Marco Aurélio da Silva
Žiūrėti daugiau!!
Dujų transformacijos
Žinokite, kas yra dujų transformacijos.
Ar norėtumėte paminėti šį tekstą mokykloje ar akademiniame darbe? Pažvelk:
SANTOS, Marco Aurélio da Silva. „Dujų tyrimas“; Brazilijos mokykla. Yra: https://brasilescola.uol.com.br/fisica/estudo-dos-gases.htm. Žiūrėta 2021 m. Birželio 27 d.