O natrio chloridas (valgomoji druska) yra druska, kurią naudojame kasdieniame darbe arba perdirbtame (pramoniniame) maiste. Tai medžiaga, kurios taip pat yra įvairiuose natūraliuose maisto produktuose, kuriuos kasdien vartojame, pavyzdžiui, vaisiuose, daržovėse, ankštinėse daržovėse, sėklose ir kt.
Šiame tekste sužinosite viską apie šią žmogaus kasdienybei svarbią medžiagą:
apibrėžimas
Natrio chloridas priklauso neorganinei druskų funkcijai ir susideda susijungus natrio katijonui (Na+) tai anijonas ctenoreto (Cl-) per a joninis ryšys.
b) Cheminės savybės
Natrio chloridą sudaro du cheminiai elementai:
→ Natris (Na):
priklauso metalų (gebančių lengvai susidaryti katijonus) šeimai šarminiai (AI);
turi elektroną valentiniame apvalkale;
turi atominį skaičių, lygų 11;
pasižymi dideliu elektropozityvumu (gebėjimu prarasti elektronus).
→ Chloras (Cl)
priklauso halogenų (VIIA) šeimai;
tai nemetalas (todėl jis taip lengvai tampa anijonu);
valentiniame apvalkale turi septynis elektronus;
turi atominį skaičių, lygų 17;
pasižymi dideliu elektronegatyvumu (gebėjimu įgyti elektronus).
Kaip du cheminiai elementai, kurie sudaro natrio chloridą, yra atitinkamai didelis elektropozityvumas ir didelis elektronegatyvumas, tarp jų yra joninis ryšys (užmegztas tarp atomų, linkusių prarasti ir įgyti elektronai).
Cheminę natrio chlorido struktūrą sudaro vienas chlorido anijonas (žalia sfera), kuris sąveikauja su šešiais natrio katijonais (mėlynomis sferomis), kaip matyti toliau pateiktoje struktūroje:
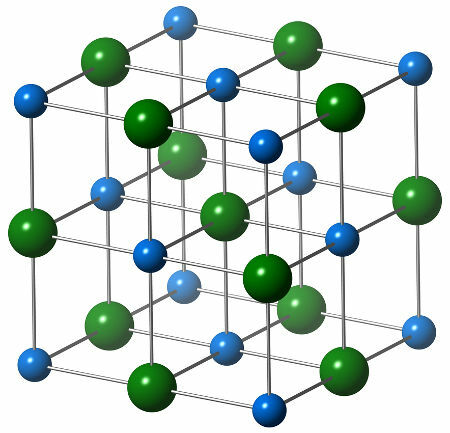
Natrio chlorido kristalinės struktūros atvaizdavimas
c) Fizinės savybės
Susiliejimo taškas:
Natrio chloridas gali būti transformuojamas iš kietos būsenos į skystą 801 temperatūroje OÇ.
Virimo taškas:
Natrio chloridas gali būti paverstas iš skysčio į dujinę būseną 1465 temperatūroje OÇ.
Poliškumas
Natrio chloridas yra poliarinis, kadangi tai medžiaga, kurią sukelia joninis ryšys, ty dėl joninio junginio.
Tirpumas vandenyje
Mes galime ištirpinti 1 L vandens, esant 25 ° C temperatūrai OC, iki 359 gramų natrio chlorido.
Tirpumas kituose tirpikliuose:
Kadangi natrio chloridas yra polinis junginys, jo negalima ištirpinti jokiuose nepolinio pobūdžio tirpikliuose, pavyzdžiui, aliejuje.
Tankis:
Natrio chlorido tankis yra 2,165 g / ml, todėl jis yra tankesnis už vandenį, kurio tankis lygus 1 g / ml.
Elektrinis laidumas:
Kadangi tai joninis junginys, natrio chloridas gali praleisti elektros srovę tik tada, kai:
-
Jis yra išlydytas, tai yra skystas;
Nesustokite dabar... Po reklamos yra daugiau;)
Ištirpsta vandenyje.
d) gavimo metodai
Natrio chloridą galima gauti fiziškai arba chemiškai:
1O) Fizinis:
trupmeninė kristalizacija
Natrio chloridas gaunamas garinant vandenį iš vandenynų.
požeminės minos
Jis išgaunamas kasyklose, naudojant kasybos metodus.
požeminiai telkiniai
Jis išgaunamas iš gilių požeminių nuosėdų ištirpinant vandenyje (telkinyje esanti druska ištirpsta) ir vėliau pumpuojama.
2O) Gaunasi chemiškai
sintezės reakcija
Natrio chloridą galima gauti cheminės sintezės reakcijos metu (dėl paprastų medžiagų susidaro sudėtinė medžiaga) tarp chloro dujų ir metalinio natrio:
2s + Cl2 g) → 2 NaCls
Neutralizavimo reakcija:
Kitas būdas natrio chloridui gauti chemiškai yra neutralizavimo reakcija tarp druskos rūgšties ir natrio hidroksido, kurioje susidaro druska ir vanduo:
HCl(1) + NaOH(čia) → NaCl(čia) + H2O(1)
e) Svarba žmonėms
Natrio chloridas pats savaime neveikia žmogaus organizme, bet kai jis disocijuojasi į natrio katijonus (Na+) ir chlorido anijonai (Cl-), kiekvienas iš šių dviejų jonų turi keletą svarbių funkcijų mūsų organizmui. Peržiūrėkite šias funkcijas:
→ Natrio katijono funkcijos (Na+)
Apsaugo nuo kraujo krešėjimo;
Kovoja su inkstų ir tulžies akmenų susidarymu;
Dalyvauja reguliuojant kūno skysčius;
Dalyvauja reguliuojant kraujospūdį.
→ Chlorido anijono (Cl-)
Dalyvavimas skrandžio sulčių formavime ir formavime (vandenilio chlorido rūgštis - HCl);
Dalyvavimas kasos sulčių formavime.
f) Žala žmogaus organizmui
Pernelyg didelis natrio chlorido vartojimas gali pakenkti žmonėms:
→ Žala, kurią sukelia pertekliniai natrio katijonai organizme:
Pailgėjęs žaizdų gijimo laikas;
Padidėjęs mėšlungis;
Padidėjęs kraujospūdis;
Inkstų perkrova;
Padidėjęs skysčių susilaikymas organizme.
→ Žala, kurią sukelia per didelis chlorido anijonų kiekis organizme:
sunaikinimas vitaminas E;
Jodo gamybos sumažėjimas organizme.
g) kitos paskirties
Natrio chloridas gali būti naudojamas ne tik druskos maistui, bet ir šiais atvejais:
Šampūnų gamyba;
Popieriaus gamyba;
Gamyba Natrio hidroksidas (NaOH);
Ploviklių gamyba;
Muilo gamyba;
Sniegas tirpsta pūgose kenčiančiose vietose;
Metalinio natrio gamyba;
Chloro dujų gamyba;
Kūno elektrolitų pakeitimo izotonikoje;
Nosies dekongestantų tirpaluose;
Druskos tirpalo gamyba; be kitų programų.
Mano. Diogo Lopes Dias
Ar norėtumėte paminėti šį tekstą mokykloje ar akademiniame darbe? Pažvelk:
DIENOS, Diogo Lopes. "Natrio chloridas (valgomoji druska)"; Brazilijos mokykla. Yra: https://brasilescola.uol.com.br/quimica/cloreto-sodio.htm. Žiūrėta 2021 m. Birželio 27 d.
Joninių junginiai, pagrindinės joninių junginių charakteristikos, jungimasis tarp jonų, galutinis elektronų perdavimas, elektrostatinės traukos jėgos tarp jonų, neigiamų ir teigiamų jonų, anijonų, katijonų, joninių jungčių, molekulinės struktūros jis
Chemija

Joninis ryšys, joninių junginių, joninių aglomeratų, natrio chlorido, valgomosios druskos, joninės medžiagos, elektrostatinės traukos jėgos, chlorido anijonai, natrio katijonai, poliniai tirpikliai, teigiami jonai, katijonai, neigiami jonai, anijonai.

