O skaičiuojant atominių dalelių skaičių naudojamas protonų (branduolyje), elektronų (elektrosferoje) ir neutronų (branduolyje) kiekiui nurodyti, esančių bet kuriame atome ar jone. Norėdami tai padaryti, būtina žinoti kai kurias atomų savybes:
1- atominis skaičius (Z)
Tai matematinis kodas, kurį žymi didžioji raidė Z, išdėstytas apatinėje kairėje atomo akronimo pusėje:
ZX
Jis nurodo protonų (p) skaičių branduolyje ir elektronų (e) skaičių atomo elektrosferoje. Taigi apskritai:
Z = p = e
2- Mišios numeris (A)
Tai matematinis kodas, atitinkantis bet kurio atomo branduolyje esančių protonų (p) ir neutronų (n) skaičių. Masės skaičių apibūdinanti lygtis pateikiama taip:
A = p + n
Kadangi protonų skaičius yra lygus atominiam skaičiui, masės skaičiui apskaičiuoti lygtį galime parašyti taip:
A = Z + n
Jei žinome atomo masės ir atomo skaičių, neutronų skaičių galime nustatyti taip:
n = A - Z
3- jonai
Jie yra atomai, kurie praranda arba įgyja elektronus. Jie turi teigiamą arba neigiamą ženklą, pateiktą viršutiniame dešiniajame jų vaizdavimo kampe, kaip parodyta šiame modelyje:
X+ arba X-
Teigiamas jonas: Tai vadinama katijonu, o teigiamas ženklas rodo, kad jis prarado elektronus.
Neigiamas jonas: Tai vadinama anijonu, o neigiamas ženklas rodo, kad jis įgijo elektronų.
Nesustokite dabar... Po reklamos dar daugiau;)
4- Atominiai panašumai
a) Izotopai
Atomai, turintys tą patį atomų skaičių ir skirtingus masės skaičius. Pavyzdys:
7X14 ir 7Y16
X ir Y atomai turi tą patį atominį skaičių (akronimo kairėje), tai yra, lygus 7. Atomo X masės skaičius (akronimo dešinėje) yra lygus 14, o atomo Y - 16.
b) izobarai
Atomai, turintys tą patį masės skaičių ir skirtingus atominius skaičius. Pavyzdys:
15X31 ir 13Y31
X ir Y atomų masės skaičius (akronimo dešinėje) yra lygus 31. Kita vertus, atomo X atomo skaičius yra lygus 15, o Y atomo skaičius yra 13.
c) Izotonai
Atomai, kurių masės ir atomų skaičiai skiriasi, tačiau neutronų skaičius yra vienodas.
d) izoelektronika
Atomai, turintys tą patį elektronų skaičių. Pavyzdys:
12X+2 ir 7Y-3
Atomas X turi atominį skaičių, lygų 12, ir yra katijonas (turintis teigiamą krūvį +2), todėl jis praranda du elektronus, taigi savo elektrosferoje turi 10 elektronų. Kita vertus, atomas Y turi atominį skaičių, lygų 7, ir yra anijonas (su neigiamu krūviu -3), todėl jis įgyja tris elektronus, taigi savo elektrosferoje turi 10 elektronų.
Minčių žemėlapis: atominės dalelės
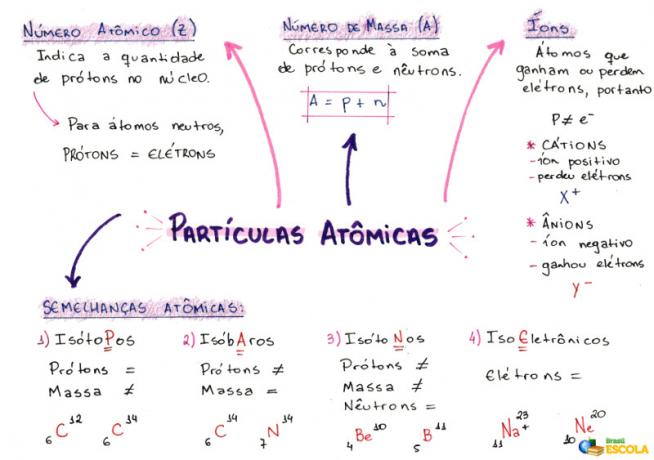
* Norėdami atsisiųsti minčių žemėlapį PDF formatu, Paspauskite čia!
Atominių dalelių skaičiavimo pavyzdžiai
1 pavyzdys: Nustatykite protonų, neutronų ir elektronų skaičių atome 14X29.
Buvo pateiktos šios atomo X vertės:
Masės numeris (viršuje dešinėje) = 29
Atomo skaičius (apačioje kairėje) = 14
Norėdami nustatyti protonų skaičių:
Protonų skaičius visada yra lygus atominiam skaičiui, taigi X atomas turi 14 protonų.
Norėdami nustatyti elektronų skaičių:
Kadangi atomas X nėra jonas, todėl elektronų skaičius yra lygus protonų skaičiui, tai yra 14.
Norėdami nustatyti neutronų skaičių:
Neutronų skaičius nustatomas pagal masės ir protonų skaičių pagal šią formulę:
A = p + n
29 = 14 + n
29 - 14 = n
n = 15
2 pavyzdys: Nustatykite jonų X protonų, neutronų ir elektronų skaičių+3, žinodami, kad jų masės skaičius ir atominis skaičius yra atitinkamai 51 ir 23.
Buvo pateiktos šios jono X vertės:
Masės skaičius = 51
Atomo skaičius (apačioje kairėje) = 23
Norėdami nustatyti protonų skaičių:
Protonų skaičius visada yra lygus atominiam skaičiui, taigi X atomas turi 23 protonus.
Norėdami nustatyti elektronų skaičių:
Jonas X yra teigiamas (+3), taigi tai yra katijonas, netekęs trijų elektronų. Taigi jo elektronų skaičius yra 20.
PASTABA: Elektronų skaičiaus sumažėjimas ar padidėjimas visada įvyksta atomo skaičiaus atžvilgiu.
Norėdami nustatyti neutronų skaičių:
Neutronų skaičius nustatomas pagal masės ir protonų skaičių pagal šią formulę:
A = p + n
51 = 23 + n
51 - 23 = n
n = 28
3 pavyzdys: Atomo W atomo skaičius ir masė yra lygūs atitinkamai 29 ir 57, tai yra a atomas Y, kurio atomo skaičius lygus 30, kuris yra atomo B izotopas, kurio masės skaičius yra 65. Turėdami šią informaciją, nustatykite protone, neutrone ir elektrone B esančio skaičiaus skaičių.
Pratyboje pateikti duomenys:
Atomas W
atominis skaičius (apačioje kairėje) = 29
masės numeris (viršuje dešinėje) = 57
Y izobaras, ty Y masė taip pat yra 57.
Y atomas
atominis skaičius = 30
masės skaičius = 57
Turėdami šias dvi reikšmes, turime nustatyti jo neutronų skaičių, nes jis yra B elemento izotonas:
A = Z + n
57 = 30 + n
57 - 30 = n
n = 27
B atomas:
masės skaičius = 65
neutronų skaičius = 27
Turėdami šiuos duomenis, turime nustatyti jo atominį skaičių, nes tuo pačiu nustatysime jo protonų skaičių ir elektronų skaičių (nes tai nėra jonas):
A = Z + n
65 = Z +27
65 - 27 = Z
Z = 38
Todėl atomas B turi 38 protonus, 38 elektronus ir 27 neutronus.
* Minčių žemėlapis Victor Ricardo Ferreira
Chemijos mokytoja
Mano. Diogo Lopes Dias