하나 화학 반응없이 동일한 용질의 용액 혼합 예를 들어 염화칼륨 (Kcl)과 같은 두 가지 용액을 동일한 용기에 모으는 것으로 구성됩니다. 이러한 유형의 혼합물에서는 동일한 용질, 즉 둘 다 동일한 양이온과 동일한 음이온을 갖기 때문에 화학 반응이 일어나지 않습니다. 따라서 이러한 특성을 가진 혼합물을 수행 할 때 두 용액을 구성하는 용질과 용매의 양을 추가하는 것 뿐이라고 말할 수 있습니다.
예를 들어 1L의 물과 4g의 KI (요오드화 칼륨) 용액을 2L의 물과 6g의 KI의 또 다른 용액과 혼합하면 3L의 물과 10g의 KI의 새로운 용액이 생성됩니다.
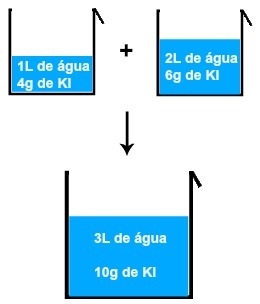
두 개의 요오드화 칼륨 용액을 혼합 한 결과
이미지를 분석하면 다음과 같은 결론을 내릴 수 있습니다. 용질의 질량 (m1')의 첫 번째 용액이 용질의 질량 (m1'') 두 번째 솔루션, 결과적으로 용질의 질량 (m에프) 최종 솔루션 (혼합):
미디엄1'+ m1''= m에프
예에서 :
4 + 6 = 10 그램
각 용액에 존재하는 물의 부피도 마찬가지입니다. 즉, 두 번째 부피 (V ')에 추가 된 첫 번째 부피 (V')의 부피가 최종 부피 (V ')가됩니다.에프):
V '+ V' '= V에프
예에서 :
1 + 2 = 3L
모든 용액에는 용해 된 용질의 양이 있고 여기에는 동일한 용질의 용액 혼합물이 있습니다. 그런 다음 위로부터 각 혼합 용액과 최종 용액의 농도 (공통, 몰 농도)를 결정할 수 있습니다..
따라서 이러한 농도를 계산하려면 공식을 기억해야합니다.
일반적인 농도 :
C = 미디엄1
V
미디엄1 = 용액 용질의 질량
V = 용액 부피
노트: m 분리1 공식에는 다음이 있습니다. 미디엄1 = CV
몰 농도 :
M = 미디엄1
미디엄1.V
미디엄1 = 용질의 몰 질량.
노트: m 분리1 공식에는 다음이 있습니다. 미디엄1 = M.M1.V
동일한 용질의 용액 혼합물이 용액 용질의 질량 합계를 다루기 때문에 다음 식에서 각 관측치를 대체 할 수 있습니다.
미디엄1'+ m1''= mF
C'.V '+ C' '. V' '= C에프.V에프
지금 멈추지 마세요... 광고 후 더 있습니다;)
C '= 용액 1의 공통 농도
C ''= 용액 2의 공통 농도
용액 혼합물의 계산에 몰 농도가 포함되는 경우 :
미디엄1'+ m1''= m에프
M'.V '+ M' '. V' '= M에프.V에프
노트: 용질이 동일하기 때문에 몰 질량은 각 용액에서 동일합니다. 따라서 계산에서 무시됩니다.
이제 봐 화학 반응없이 동일한 용질의 용액 혼합물에서 계산을 포함하는 예:
예 1 : (Mackenzie-SP-Adaptada) 동일한 염기의 84g / L 용액의 특정 부피 (v)에 14g / L KOH 용액 600mL를 추가하면 67.2g / L 용액이됩니다. 84g / L 용액의 추가 된 부피 (v)는 다음과 같습니다.
a) 0100 mL
b) 3000ml
c) 2700ml
d) 1500ml
e) 1900mL
실습에서 제공 한 데이터는 다음과 같습니다.
V '= 600mL
C '= 14g / L
V ''=?
C ''= 84g / L
V에프 = ?
CF = 67.2g / L
솔루션 1의 추가 부피를 결정하기 전에 먼저 다음 식을 사용하여 최종 부피를 결정해야합니다.
V '+ V' '= V에프
600 + V ''= V에프
아래의 수학 식에 주어진 값을 대체하면 다음과 같습니다.
C'.V '+ C' '. V' '= C에프.V에프
14. 600 + 84.V ''= 67.2. (600 + V '')
8400 + 84.V ''= 67.2. 600 + 67.2.V ''
8400 + 84.V ''= 40320 + 67.2.V ''
84.V ''– 67.2.V ''= 40320 – 8400
16.8.V ''= 31920
V ''= 31920
16,8
V ''= 1900mL
예 2 : (UFOP) 1000mL 부피 플라스크에 2M 황산 용액 250mL에 동일한 산의 1M 용액 300mL를 첨가하고 증류수로 부피를 1000mL로 만들었다. 결과 용액의 몰 농도를 결정하십시오.
실습에서 제공 한 데이터는 다음과 같습니다.
V '= 250mL
M '= 2M
V ''= 300mL
M ''= 1M
V에프 = 1000ml
미디엄에프 = ?
최종 솔루션의 몰 농도를 결정하려면 프로세스를 나타내는 수학 식을 사용하십시오.
M'.V '+ M' '. V' '= M에프.V에프
2. 250 + 1. 300 = M에프.1000
500 + 300 = M에프. 1000
800 = M에프
1000
미디엄에프 = 0.8 mol / L
나로. Diogo Lopes Dias
이 텍스트를 학교 또는 학업에서 참조 하시겠습니까? 보기:
일, Diogo Lopes. "화학 반응없이 동일한 용질의 용액 혼합물"; 브라질 학교. 가능: https://brasilescola.uol.com.br/quimica/mistura-solucoes-mesmo-soluto-sem-reacao-quimica.htm. 2021 년 6 월 27 일 액세스.



