열학 연구에서 우리는 그것을 단열 변환 외부 환경과의 열 교환이없는 가스 변환. 따라서 단열 변환에서 열은 0입니다.
Q = 0
열역학 제 1 법칙을 적용하면 다음과 같은 이점이 있습니다.
Q = ∆U + τ
∆U =-τ
그러나 외부 환경간에 열 교환이 없다는 것은 무엇을 의미합니까? 가스 팽창이 일어나고 가스가 300J 작업을 수행하면 매체와 열 교환이 있으면 가스 내부 에너지의 변화가 음수이므로 우리는 :
∆U = -300J
이제 가스의 내부 에너지가 감소하면 가스의 온도도 감소했다고 말할 수 있습니다. 가스의 일반 법칙에서

부피가 증가하고 가스 온도가 감소하면 반드시 가스 압력도 감소한다고 말할 수 있습니다. 일반적으로 압축도 마찬가지라고 말할 수 있습니다. 압축이 있으면 가스의 내부 에너지가 증가하여 압력도 증가하기 때문입니다.
마인드 맵: 단열 변환
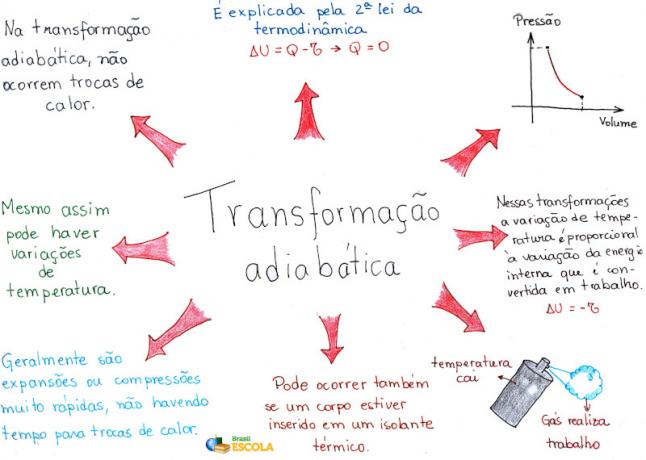
* 마인드 맵을 PDF로 다운로드하려면 여기를 클릭하세요!
간단히 말해서 다음과 같이 말할 수 있습니다.
-단열 팽창, 온도 및 압력 감소;
-단열 압축에서는 온도와 압력이 모두 증가합니다.
아래 차트는 단열 변환에 대한 개요를 제공합니다.
단열 변환은 단열 용기를 사용하거나 압축 또는 매우 빠른 팽창을 통해 얻을 수 있습니다.
따라서 우리는 가스가 외부 환경과 열을 교환 할 때 열이 가스 질량을 통해 전파되고 평형 상태가되는 데 약간의 시간이 걸린다는 결론을 내릴 수 있습니다. 따라서 팽창과 급속 압축이 모두 수행되면 외부 매체와의 열교환이 거의 없습니다.
* 마인드 맵 by Me. Rafael Helerbrock
Domitiano Marques 작성
물리학 졸업
출처: 브라질 학교- https://brasilescola.uol.com.br/fisica/estudo-transformacao-adiabatica.htm


