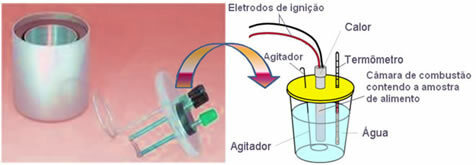
칼로리의 양은 음식의 구성에 따라 다릅니다. 따라서 음식에서 방출되고 신체에 흡수 될 수있는 열의 양을 실험적으로 결정하기 위해 우리는 열량계.
이 장치는 음식을 태울 때 방출되는 열을 측정합니다. 열량계에는 여러 유형이 있습니다. 그들 중 첫 번째는 Lavoisier와 Laplace에 의해 1780 년에 만들어졌으며 얼음 열량계.
요즘 가장 많이 사용되며 위에서 설명한 칼로리 개념을 고려한 것은 물 열량계. 이 장치는 매체의 열 손실을 방지하기 위해 절연 재료로 코팅되어 있습니다. 분석 할 음식은 연소실, 산소 가스와 전극. 이 전극은 방전되어 음식물이 점화되고 연소됩니다.
열량계에 포함 된 알려진 양의 물은 구운 음식에서 방출되는 열을 흡수하고 온도계 수온 상승을 측정합니다. 또한 열량계에는 선동자 물의 온도가 전체적으로 균일하게 유지되도록합니다.
예를 들어 설탕 1g의 질량을 사용하고 열량계에는 1000g의 물이 있고 결국에는 반응의 수온이 20 ° C에서 24 ° C로 상승했습니다. 즉, 4 ° C 상승한 다음 에너지 값에 도달 할 수 있습니다. 설탕. 처럼? 글쎄요, 초기 칼로리 개념을 고려하면 다음과 같습니다.
| 1 ° C → 물 1g 당 1 칼로리 상승 |
| 4 ° C → 물 그램 당 4 칼로리 상승 |
따라서 물 1g은 석회 4 개를 흡수합니다. 그러나 1000g의 물이 사용되었고 연소시 방출되는 모든 열이 그것에 의해 흡수된다는 점을 고려할 때 물이 흡수하는 총 에너지는 4000cal 또는 4kcal입니다. 따라서 다음과 같은 결론을 내립니다.
| 설탕의 에너지 값 = 4000cal / g 또는 4kcal / g. |
SI 로의 전환 :
1kcal 4.18 kJ
4kcal / g x
x = 16.72 kJ / g
또한 다음 방정식을 사용하여 물이 주거나 흡수하는 열의 양을 계산할 수 있습니다.
| Q = m. 씨. 티 |
어디:
Q = 물에 의해 열이 방출되거나 흡수됨;
m = 물의 질량;
c = 물의 비열, 1.0 cal / g와 같습니다. ° C 또는 4.18 J / g. ° C;
Δt = 물이받는 온도의 변화, 이것은 초기 온도에 의한 최종 온도의 감소로 주어집니다 (t에프 – t나는).
이 공식을 사용하면 동일한 결과를 얻습니다.
Q = m. 씨. 티
Q = 1000g. 1.0 cal / g. ° C. (24-20) ° C
Q = 4000 칼로리
Q = 4.0kcal
또는
Q = m. 씨. 티
Q = 1000g. 4.18 kJ / g. ° C. (24-20) ° C
Q = 16.72 kJ
작성자: Jennifer Fogaça
화학 전공
출처: 브라질 학교- https://brasilescola.uol.com.br/quimica/medindo-as-calorias-dos-alimentos-por-meio-um-calorimetro.htm